
【題目】鉬酸鈉晶體(Na2MoO4·2H2O)常用于制造阻燃劑和無公害冷水系統的金屬抑制劑。如圖是利用鉬精礦(主要成分是MoS2,含少量PbS等)為原料生產鉬酸鈉晶體的工藝流程圖:

回答下列問題:
(1)提高焙燒效率的方法有__。(寫出兩種)
(2)“焙燒”時MoS2轉化為MoO3,該反應過程的氧化產物是__(寫化學式)。
(3)“堿浸”時含鉬化合物發生的主要反應的化學方程式為__。鉬精礦在堿性條件下,加入NaClO溶液,也可以制備鉬酸鈉,同時有SO42-生成,該反應的離子方程式為___。
(4)若“除重金屬離子”時加入的沉淀劑為Na2S,則廢渣成分的化學式為__。
(5)測得“除重金屬離子”中部分離子的濃度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“結晶”前需先除去SO42-,方法是加入Ba(OH)2固體。假設加入Ba(OH)2固體后溶液體積不變,當SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)時,BaMoO4是否會析出?__。(請計算說明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)“重結晶”過程的具體操作是:__。
【答案】①粉碎固體顆粒;②空氣大大過量 MoO3、SO2 MoO3+Na2CO3=Na2MoO4+CO2↑ MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O PbS 當c(SO42-)=1.0×10-5mol/L,c(Ba2+)= 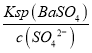 ==1.1×10-5mol/L,c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以會析出BaMoO4沉淀 “結晶”得到的粗品溶解得到溶液,蒸發濃縮,冷卻結晶,過濾、洗滌、干燥
==1.1×10-5mol/L,c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以會析出BaMoO4沉淀 “結晶”得到的粗品溶解得到溶液,蒸發濃縮,冷卻結晶,過濾、洗滌、干燥
【解析】
據題分析工藝流程圖:鉬精礦經焙燒轉化為MoO3,再用Na2CO3溶液處理得到Na2MoO4,用沉淀劑將重金屬沉淀,過濾后所得濾液經處理進行結晶、重結晶等過程最終獲得產品。
(1)可采取將鉬精礦粉碎或通入過量的空氣提高焙燒效率;
答案為:①粉碎固體顆粒,②空氣大大過量;
(2)MoS2中Mo和S的化合價分別為+4、-2,“焙燒”時MoS2轉化為MoO3和SO2,Mo和S的化合價均升高,所以,該反應過程的氧化產物是MoO3和SO2;
答案為:MoO3、SO2;
(3)根據題意分析可知,“堿浸”時MoO3和Na2CO3反應生成Na2MoO4,所以,該化學方程式為:MoO3+Na2CO3=Na2MoO4+CO2↑;MoS2在堿性條件下,加入NaClO溶液,也生成鉬酸鈉,同時有SO42-生成,Mo和S被氧化,則Cl應被還原成Cl-,根據電子守恒、電荷守恒、質量守恒,可寫出該反應的離子方程式:MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O;
答案為:MoO3+Na2CO3=Na2MoO4+CO2↑;MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O;
(4)若“除重金屬離子”時加入的沉淀劑為Na2S,則有反應:Pb2+ + S2- = PbS↓,所以廢渣成分為PbS;
答案為:PbS;
(5)當c(SO42-)=1.0×10-5mol/L,c(Ba2+)=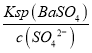 =
=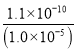 =1.1×10-5(mol/L),c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以會析出BaMoO4沉淀;
=1.1×10-5(mol/L),c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以會析出BaMoO4沉淀;
答案為:當c(SO42-)=1.0×10-5mol/L,c(Ba2+)=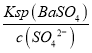 ==1.1×10-5mol/L,c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以會析出BaMoO4沉淀;
==1.1×10-5mol/L,c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以會析出BaMoO4沉淀;
(6)“重結晶”過程的具體操作是:為除去“結晶”得到的粗品中的可溶性雜質,可將粗品溶解得到溶液,蒸發濃縮,冷卻結晶,過濾、洗滌、干燥;
答案為:“結晶”得到的粗品溶解得到溶液,蒸發濃縮,冷卻結晶,過濾、洗滌、干燥。


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.14g乙烯和丙烯的混合物完全燃燒時,產生的CO2分子數目為0.5NA
B.1L0.1mol/L的CH3COONa溶液中含有的CH3COO-數目為0.1NA
C.15.6g由Na2S和Na2O2組成的混合物中,含有的陰離子數目為0.2NA
D.標準狀況下,16gO2和O3混合物中含有的氧原子數目為0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物![]() (甲)、
(甲)、 (乙)、
(乙)、 (丙)的分子式均為C8H8,下列說法不正確的是
(丙)的分子式均為C8H8,下列說法不正確的是
A. 甲、乙、丙在空氣口燃燒時均產生明亮并帶有濃煙的火焰
B. 甲、乙、丙中只有甲的所有原子可能處于同一平面
C. 等量的甲和乙分別與足量的溴水反應,消耗Br2的量:甲>乙
D. 甲、乙、丙的二氯代物數目最少的是丙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某模擬“人工樹葉“的電化學實驗裝置如圖所示,該裝置能將H2O和CO2轉化為 O2和燃料(C3H8O),下列說法不正確的是( )
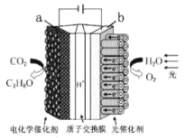
A.該裝置工作時,H+從b極區向a極區遷移
B.a電極的反應為:3CO2+18H++18e-= C3H8O +5H2O
C.每生成1moO2, 有44g CO2被還原
D.C3H8O形成燃料電池以氫氧化鈉溶液作為電解質溶液的負極反應式C3H8O-18H++24OH-=3CO32-+16H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Wilson病是一種先天性銅代謝障礙性疾病,D-青霉胺具有排銅作用,用以治療或控制Wilson病癥。D-青霉胺結構簡式如圖:
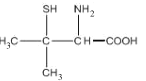
回答下列問題:
(1)寫出Cu的簡化電子排布式________。
(2)已知氣態基態原子得到一個電子形成氣態基態負一價離子所產生的能量變化稱為該元素原子的第一電子親合能(吸收能量為負值,釋放能量為正值),試解釋碳原子第一電子親合能較大的原因 _________。 第一電子親合能可能為正值或負值,而第二電子親合能均為負值,原因是_____。
(3)D-青霉胺中,硫原子的VSEPR模型為____,碳原子的雜化方式為_______。
(4)請簡述D-青霉胺能溶于水的主要原因________。
(5)青霉胺在臨床治療時對于癥狀改善較慢,常有并發癥出現,因而近年采用鋅劑(ZnSO4)替代治療,可由硫化鋅制備。立方硫化鋅晶胞與金剛石晶胞類似,結構如圖
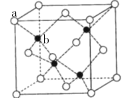
其中a代表S2-,b代表Zn2+。則該晶胞中S2-的配位數為______,若晶體的密度為ρg·cm-3,則晶胞的體積為________ cm3(列出計算式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.標準狀況下,1.12LCl2溶于2L水,溶液中含氯粒子的數目等于0.1NA
B.含有C-Si鍵數目為2NA的SiC晶體中硅原子的物質的量為1mol
C.14.0gFe發生吸氧腐蝕最終生成Fe2O3·xH2O,電極反應轉移的電子數為0.5NA
D.室溫下,0.05mol/L的硝酸銨溶液中氮原子數目為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酒精檢測儀可幫助執法交警測試駕駛員飲酒的多少,其工作原理示意圖如圖所示。反應原理為:CH3CH2OH+O2=CH3COOH+H2O,被測者呼出氣體中所含的酒精被輸送到電池中反應產生微小電流,該電流經電子放大器放大后在液晶顯示屏上顯示其酒精含量。下列說法正確的是

A. b為正極,電極反應式為:O2+4H++4e-=2H2O
B. 電解質溶液中的H+移向a電極
C. 若有0.4mol電子轉移,則在標準狀況下消耗4.48L氧氣
D. 呼出氣體中酒精含量越高,微處理器中通過的電流越小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列解釋事實的方程式不正確的是
A.用 Na2CO3 溶液將水垢中的 CaSO4 轉化為 CaCO3:CO3 2-+Ca2+ =CaCO3↓
B.電解飽和食鹽水產生黃綠色氣體:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
C.紅熱木炭遇濃硝酸產生紅棕色氣體:C+4HNO3(濃) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
D.用新制 Cu(OH)2 檢驗乙醛,產生紅色沉淀:CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在體積固定的密閉容器中發生反應:![]() 。下列敘述中不能說明上述反應已達到化學平衡狀態的是
。下列敘述中不能說明上述反應已達到化學平衡狀態的是
A.混合氣體的密度不變
B.體系的壓強不變
C.混合氣體的平均相對分子質量不變
D.反應體系中乙醇的物質的量濃度不再變化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com