
| A. | 2項 | B. | 3項 | C. | 4項 | D. | 5項 |
分析 ①裂解汽油主要成分為C6~C9烴類;
②石油裂解能得到乙烯,乙烯可發生加聚反應;
③天然氣的主要成分為甲烷,燃燒生成二氧化碳和水;
④四氯化碳的密度比水大,環己烯含有碳碳雙鍵,環己烷與高錳酸鉀不反應,密度比水小;
⑤石油產品含有烷烴;
⑥苯存在同分異構體;
⑦煤可以先轉化為一氧化碳和氫氣,再在催化劑作用下合成甲醇;
⑧石油中含有1~50個碳原子的烷烴及環烷烴.
解答 解:①裂解汽油主要成分為C6~C9烴類,為混合物,故錯誤;
②石油裂解可以得到含有乙烯、丙烯、丁二烯等不飽和烴外,還含有甲烷、乙烷、氫氣等氣體,乙烯氣體發生加聚反應得到聚乙烯,故正確;
③天然氣的主要成分為甲烷,燃燒生成二氧化碳和水,為清潔燃料,故正確;
④四氯化碳的密度比水大,環己烯含有碳碳雙鍵,環己烷與高錳酸鉀不反應,密度比水小,可用高錳酸鉀溶液鑒別,故正確;
⑤石油產品含有烷烴,不能發生加聚反應,故錯誤;
⑥苯存在同分異構體,故錯誤;
⑦煤可以先轉化為一氧化碳和氫氣,再在催化劑作用下合成甲醇,從而實現液化,故正確;
⑧石油中含有1~50個碳原子的烷烴及環烷烴,故正確.
故選D.
點評 本題考查較為綜合,涉及多方面知識的考查,側重于化學與生活、生產的考查,有利于培養學生良好的科學素養,提高學習的積極性,注意相關基礎知識的積累,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | a、c兩種元素只能組成化學式為ca3的化合物 | |
| B. | b、c、d分別與a形成的簡單化合物,沸點由高到低依次為:d>c>b | |
| C. | 原子半徑由大到小的順序是 e>f>c>b>a | |
| D. | 元素的非金屬性由強到弱的順序是 d>c>f>b |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 陰離子的還原性:W>Z | B. | 單質的沸點:W>Y | ||
| C. | 最高價氧化物的水化物的酸性:Y<Z | D. | 四種元素一定都是非金屬元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
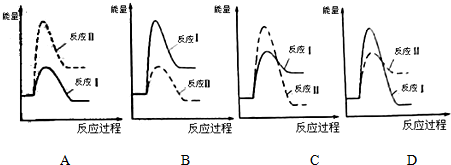
 Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.
Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
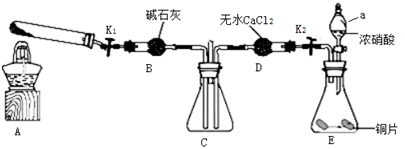
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
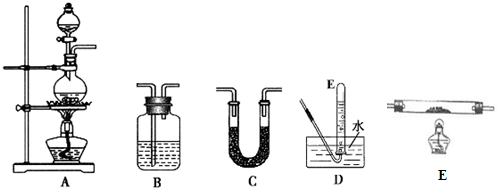
| 選用的儀器 | 加入的試劑 |
| A | 甲酸、濃硫酸 |
| D | -- |
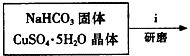
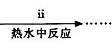
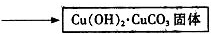
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋼鐵腐蝕時可能發生的正極反應為:2H2O+O2+4e-=4OH- | |
| B. | 向沸水中滴入幾滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | 1L0.5mol•L-1稀硫酸與1L1mol•L-1氫氧化鈉溶液反應放出57.3kJ的熱量: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6kJ•mol-1 | |
| D. | 向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗步驟 | 實驗現象 |
| 將打磨過的鋁片(過量)放入一定濃度的CuCl2溶液中. | 產生氣泡,析出疏松的紅色固體,溶液逐漸變為無色. |
| 反應結束后分離出溶液備用 | \ |
| 紅色固體用蒸餾水洗滌后,置于潮濕空氣中. | 一段時間后固體由紅色變為綠色[視其主要成分為Cu2(OH)2CO3] |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com