
| m |
| M |
| 0.042g |
| 12g/mol |
| 250 |
| 25 |
| 16.8g×5% |
| 40g/mol |
| 0.0015mol |
| 0.01L |
| 3.584L |
| 22.4L/mol |
| 0.7mol-0.16mol |
| 2 |
|
| 0.02mol×89g/mol |
| 0.02mol×89g/mol+0.25mol×56g/mol+2.02g |


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:
| A、標準狀況下C2H4氣體22.4L,所含電子數為16NA |
| B、0.1mol鐵在純氧中充分燃燒,失電子數為0.3NA |
| C、1L 0.2mol/L的氯化鐵溶液中,氯離子數為0.6NA |
| D、室溫下,16g甲烷含有共價鍵數為4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、為了降低成本,用工業酒精來兌酒 |
| B、油脂水解可制得肥皂 |
| C、使用太陽能等代替化石燃料,符合低碳節能減排的要求 |
| D、棉花與合成纖維的主要成分均為纖維素 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 運用化學反應原理研究元素及其化合物的反應有重要意義.
運用化學反應原理研究元素及其化合物的反應有重要意義.查看答案和解析>>
科目:高中化學 來源: 題型:
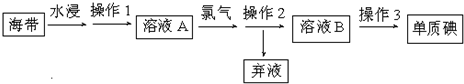
查看答案和解析>>
科目:高中化學 來源: 題型:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3+ |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

| 序號 | 實驗方案 | 實驗現象 | 結論 |
| ① | 取少量稀釋后的溶液A加入淀粉溶液后再用硫酸酸化,分裝于試管Ⅰ、Ⅱ | 無現象 | |
| ② | 往試管Ⅰ中加入 | 無現象 | 灼燒后碘元素不是以IO3-形式存在 |
| ③ | 往試管Ⅱ中加入 | 灼燒后碘元素以I-形式存在 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com