
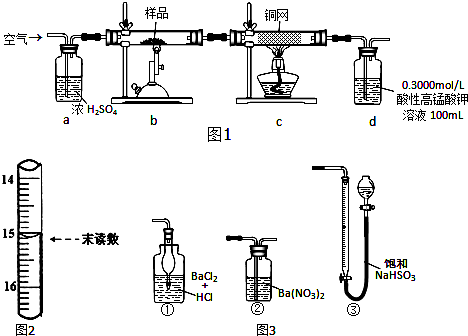
分析 (1)稱取研細的樣品4.000g,由質量的精確度可知不能用托盤天平來稱量;
(2)裝置a為除去空氣中的水蒸氣避免影響測定結果,同時可以觀察氣體流速控制反應進行的速率;
(3)繼續通入空氣目的是把裝置中的二氧化硫氣體全部趕出完全吸收;
(4)草酸被高錳酸鉀溶液氧化為二氧化碳,高錳酸鉀被還原為錳離子;依據滴定管的結構,利用開始和結束的體積差值計算得到消耗草酸溶液的體積;
(5)依據灼燒反應和滴定反應的定量關系計算硫化亞鐵的質量分數;
(6)裝置d是用于吸收并測定產物中二氧化硫的含量,根據二氧化硫的化學性質進行判斷.
解答 解:(1)稱取研細的樣品4.000g,由質量的精確度可知不能用托盤天平來稱量,托盤天平的精確度為0.1g,
故答案為:不能;
(2)分析裝置圖可知為準確測定樣品中FeS2樣品的純度,利用空氣中的氧氣氧化硫化亞鐵反應生成二氧化硫被高錳酸鉀溶液吸收后,用草酸滴定計算,過程中空氣中的水蒸氣會干擾測定,需要通過濃硫酸除去,所以裝置 a的作用是干燥或除去水蒸氣,同時根據氣泡冒出觀察氣體流速,
故答案為:干燥空氣,觀察氣體流速;
(3)繼續通入空氣目的是把裝置中的二氧化硫氣體全部趕出完全吸收,減少誤差,
故答案為:促進裝置中的二氧化硫氣體全部吸收;
(4)草酸被高錳酸鉀溶液氧化為二氧化碳,高錳酸鉀被還原為錳離子,反應的離子方程式為:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,依據滴定管的結構,利用開始和結束的體積差值計算得到消耗草酸溶液的體積為:15.10mL-0.10mL=15.00mL,
故答案為:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(5)依據反應的離子方程式計算與二氧化硫反應的高錳酸鉀物質的量,得到二氧化硫的物質的量,結合元素守恒計算硫化亞鐵的質量分數,結合反應的離子方程式計算得到:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,100mL溶液中剩余高錳酸鉀物質的量為:$\frac{2}{5}$×0.01500L×0.1000mol/L×10=0.006mol,與二氧化硫反應的高錳酸鉀物質的量為:0.3000mol/L×0.1000L-0.006mol=0.024mol,結合反應5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4可得:
5FeS2~10SO2~4KMnO4
5 4
n(FeS2) 0.024mol
n(FeS2)=0.03mol
樣品中FeS2的純度為:$\frac{0.03mol×120g/mol}{4.000g}$×100%=90%,
故答案為:90%;
(6)圖3中,只有②能夠與二氧化硫反應生成硫酸鋇沉淀,可以替代裝置d;而①無法吸收二氧化硫,③中空氣不溶于水,干擾了二氧化硫的測定,
故答案為:②.
點評 本題考查了物質組成的實驗探究方法分析,題目難度中等,理解反應原理和滴定實驗的計算是解題關鍵,試題充分考查學生的分析、理解能力及化學實驗能力.


 暑假銜接教材期末暑假預習武漢出版社系列答案
暑假銜接教材期末暑假預習武漢出版社系列答案 假期作業暑假成長樂園新疆青少年出版社系列答案
假期作業暑假成長樂園新疆青少年出版社系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②①③ | C. | ③①② | D. | ③②① |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.
研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 96% | B. | 48% | C. | 9.6% | D. | 56% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com