
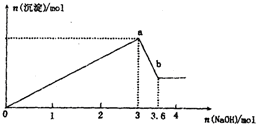
 現有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物質的量隨加入的NaOH的物質的量的關系如圖.
現有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物質的量隨加入的NaOH的物質的量的關系如圖.分析 (1)首先發生的反應Fe2++2OH-═Fe(OH)2↓、Al3++3OH-═Al(OH)3↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3,然后發生Al(OH)3+OH-═AlO2-+2H2O,據此解答;
(2)由圖可知,溶解氫氧化鋁沉淀消耗氫氧化鈉為0.6mol,根據方程式計算氫氧化鋁的物質的量,利用鋁元素守恒計算氯化鋁的物質的量;
(3)根據反應FeCl3+3NaOH=Fe(OH)3↓+3NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl可知,生成0.6mol氫氧化鋁消耗氫氧化鈉是1.8mol,所以和氯化鐵反應的氫氧化鈉是3mol-1.8mol=1.2mol,因此氯化鐵是0.4mol,再根據c=$\frac{n}{V}$計算;
(4)根據取原溶液50mL,加入0.1mol鹽酸得到新溶液,其中的成分有:FeCl3、AlCl3、HCl,向其中加入NaOH溶液時,先發生HCl+NaOH═NaCl+H2O反應,當將HCl反應完后,在發生與FeCl3、AlCl3的生成沉淀,方程式為:AlCl3+3NaOH═Al(OH)3↓+3NaCl,FeCl3+3NaOH═Fe(OH)3↓+3NaCl,
完全反應后又發生反應 Al(OH)3+NaOH═NaAlO2+2H2O.
解答 解:(1)加入0-3molNaOH階段,發生反應Fe2++2OH-═Fe(OH)2↓、Al3++3OH-═Al(OH)3↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3,a點沉淀達最大值,故a點對應的沉淀的化學式為:Fe(OH)3、Al(OH)3,
故答案為:Fe(OH)3、Al(OH)3;
(2)由圖可知,溶解氫氧化鋁沉淀消耗氫氧化鈉為3.6m0l-3mol=0.6mol,根據Al(OH)3+OH-═AlO2-+2H2O可知,氫氧化鋁的物質的量=0.6mol,根據鋁元素守恒可知氯化鋁的物質的量=0.6mol,故答案為:0.6mol;
(3)FeCl3溶液的濃度為$\frac{0.4mol}{0.1L}$=4mol/L,故答案為:4;
(4)根據取原溶液50mL,加入0.1mol鹽酸得到新溶液,其中的成分有:FeCl3、AlCl3、HCl,向其中加入NaOH溶液時,先發生HCl+NaOH═NaCl+H2O反應,當將HCl反應完后,在發生與FeCl3、AlCl3的生成沉淀,方程式為:AlCl3+3NaOH═Al(OH)3↓+3NaCl,FeCl3+3NaOH═Fe(OH)3↓+3NaCl,
完全反應后又發生反應 Al(OH)3+NaOH═NaAlO2+2H2O.
設50mL原溶液中FeCl3、AlCl3的物質的量分別為:0.2mol、0.3mol,
設中和0.1molHCl消耗的NaOH物質的量為xmol,則有:
HCl+NaOH═NaCl+H2O
1 1
0.1ol x
則有:1:1═0.1mol:x
解得:x═0.1mol.
設反應掉0.4molFeCl3消耗消耗的NaOH物質的量為ymol,則有:
FeCl3+3NaOH═Fe(OH)3↓+3NaCl
1 3
0.2mol y
則有:1:3=0.2mol:y
解得:y═0.6mol
設反應掉0.6molAlCl3消耗的NaOH物質的量為zmol,生成Al(OH)3↓+zmol則有:
AlCl3+3NaOH═Al(OH)3↓+3NaCl
1 3 1
0.3mol y z
則有:3:1=0.3 mol:y
解得:y=1.1mol;z═0.3mol
所以,加入氫氧化鈉溶液將原溶液中的FeCl3、AlCl3、HCl,全部反應完畢時,共消耗1mol.
再加入NaOH就與生成的Al(OH)3反應.
設反應掉0.3molAl(OH)3消耗的NaOH物質的量為nmol,則有:
Al(OH)3+NaOH═NaAlO2+2H2O
1 1
0.3mol n
則有:1:1═0.3 mol:n
解得:n=0.3mol.
結合反應現象及反應的量的關系,畫出生成沉淀的物質的量隨加入的NaOH的物質的量的關系圖.
故答案為: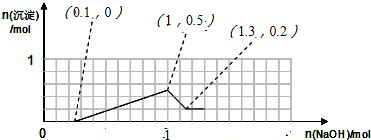 .
.
點評 本題是一道對鋁鹽與強堿反應的問題的考查,需要將化學變化過程與化學現象的分析結合起來,并將變化過程體現在圖象中,考查綜合性強,需要細心認真.


 中考解讀考點精練系列答案
中考解讀考點精練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 元素Y的最高正化合價為+6 | |
| B. | 簡單離子半徑的大小順序為W>Q>Z>X>Y | |
| C. | 氣態氫化物的穩定性:Q>W | |
| D. | 元素W的最高價氧化物對應的水化物酸性比Q的強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下將pH=2的硫酸和pH=12的MOH溶液等體積混合,所得溶液pH≤7 | |
| B. | 已知同溫度相同濃度的NaNO2溶液比NaF溶液的堿性強,所以氫氟酸的酸性比亞硝酸的弱 | |
| C. | 常溫下,將醋酸鈉、鹽酸兩溶液混合后,溶液呈中性,則有c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | pH相等的NH4Cl、(NH4)2SO4、NH4HSO4三種溶液物質的量濃度為c(NH4Cl)>c((NH4)2SO4)=c(NH4HSO4) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 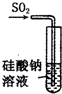 裝置:可證明H2SiO3酸性與H2SO3酸性強 | |
| B. |  裝置:橡膠管的作用是能使水順利流下 | |
| C. |  裝置:用圖示的方法能檢查此裝置的氣密性 | |
| D. | 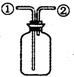 裝置:可在瓶中先裝入某種液體收集NO氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強堿溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 含0.1mol?L-1Fe3+的溶液中:K+、Ba2+、NO3-、SO42- | |
| C. | 含0.1mol?L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 室溫下c(H+)=0.1mol?L-1的溶液中:Na+、Fe3+、NO3-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe304與稀硝酸反應的離子方程式為:3Fe3O4+28H++N03一═9Fe3++NO↑+14H20 | |
| B. | 用稀硫酸除去銅綠:4H++Cu2(OH)2CO3═2Cu2++C02↑+3H2O | |
| C. | 向NH4Al(S04)2溶液中滴人Ba(OH)2溶液恰好使S042-完全沉淀:2Ba2-+NH4++Al3++2SO42-+40H-═Al(OH)3↓+NH3•H20+2BaSO4↓ | |
| D. | 少量氫氧化鈣溶液與碳酸氫鈉溶液混合:Ca2++OH-+HC03-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
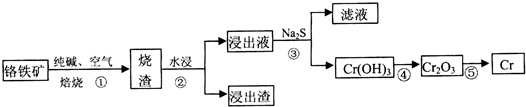 a.操作①中為加熱焙燒速率和提高原料的利用率,可采取的措施是將鉻鐵礦粉碎(答一條即可).
a.操作①中為加熱焙燒速率和提高原料的利用率,可采取的措施是將鉻鐵礦粉碎(答一條即可).| 溫度/K | 480 | 505 | 615 | 730 |
| 質量/g | 94.67 | 92.00 | x | 76.00 |
| 化學式 | Cr3O8 | y | CrO2 | Cr2O3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com