
【題目】如圖裝置閉合電鍵K時,電流計A的指針將發生偏轉。試回答:
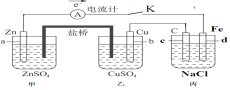
(1)丙池是___(填“原電池”或“電解池”)。
(2)乙中Cu極的電極反應是___,若電路中有0.02mol電子通過,則甲中a電極溶解的質量為___g。
(3)閉合電鍵K一段時間后,丙池中生成二種氣體和一種堿,則丙池中發生的總的離子反應方程式是___。
(4)如果要給丙中鐵片上鍍上一層Ag,則丙池應作何改進___。
(5)丙池中反應進行較長時間后,收集到標準狀況下氫氣2.24L。此時測得丙池溶液質量實際減少4.23g,含有堿0.100mol(不考慮氣體在水中的溶解),則實際放出氣體的物質的量是___mol。
【答案】電解池 Cu2++2e﹣=Cu 0.65 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 把C電極換成Ag電極,把NaCl溶液換為硝酸銀溶液 0.165
2OH-+H2↑+Cl2↑ 把C電極換成Ag電極,把NaCl溶液換為硝酸銀溶液 0.165
【解析】
(1)甲和乙形成原電池,所以丙有外加電源;
(2)乙中Cu極上陽離子得電子;根據電子與Zn的物質的量關系求算;
(3)丙池中是電解NaCl溶液生產氫氣,氯氣和氫氧化鈉;
(4)如果要給丙中鐵片上鍍上一層Ag,則丙池為電鍍池;
(5)根據電解NaCl溶液生產氫氣,氯氣和氫氧化鈉的關系,已知堿0.100mol,求氯氣,再由丙池溶液質量實際減少的量,求出氧氣的質量。
(1)甲和乙形成原電池,所以丙有外加電源,屬于電解池;
(2)乙中Cu極上銅離子得電子生成銅單質,其電極反應為:Cu2++2e-=Cu;Zn從0價升高到+2價失去2個電子,已知電路中有0.02mol電子通過,所以消耗的Zn為0.01mol,m(Zn)=nM=65g/mol×0.01mol=0.65g;
(3)丙池中是電解NaCl溶液生產氫氣,氯氣和氫氧化鈉,其電解方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,對應的離子反應方程式為2Cl-+2H2O
2NaOH+H2↑+Cl2↑,對應的離子反應方程式為2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(4)要給丙中鐵片上鍍上一層Ag,則陽極應該為Ag電極,電解質溶液為AgNO3溶液,即把C電極換成Ag電極,把NaCl溶液換為硝酸銀溶液;
(5)已知堿0.100mol,n(H2)=![]() =
=![]() =0.1mol,
=0.1mol,
2NaCl+2H2O![]() 2NaOH + H2↑+Cl2↑;
2NaOH + H2↑+Cl2↑;
0.1mol 0.05mol
所以m(H2)=nM=0.1mol×2g/mol=0.2g,m( Cl2)=nM=0.05mol×71g/mol=3.55g,丙池溶液質量實際減少4.23g,是氫氣、氯氣和氧氣的質量和,所以m(O2)=4.23g-3.55g-0.2g=0.48g,所以n(O2)=![]() =
=![]() =0.015mol,因此實際放出氣體的物質的量是:0.1mol+0.05mol+0.015mol=0.165mol。
=0.015mol,因此實際放出氣體的物質的量是:0.1mol+0.05mol+0.015mol=0.165mol。


科目:高中化學 來源: 題型:
【題目】鈦(Ti)被稱為“未來金屬”,廣泛應用于國防、航空航天、生物材料等領域。鈦的氯化物有如下轉變關系:2TiCl3![]() TiCl4↑+TiCl2回答下列問題。
TiCl4↑+TiCl2回答下列問題。
(1)某同學所畫基態 Cl-的外圍電子排布圖為![]() ,這違反了____________
,這違反了____________
(2)從結構角度解釋 TiCl3中Ti(III)還原性較強的原因____________。
(3)鈦的氯化物的部分物理性質如下表:
氯化物 | 熔點/℃ | 沸點/℃ | 溶解性 |
TiCl4 | -24 | 136 | 可溶于非極性的甲苯和氯代烴 |
TiCl2 | 1035 | 1500 | 不溶于氯仿、乙醚 |
①TiCl4與TiCl2的晶體類型分別是____________。
②TiCl4與SO42-互為等電子體,因為它們____________相同;SO42-中心原子以3s軌道和3p軌道雜化。
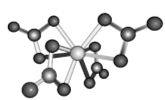
(4)Ti的配合物有多種。Ti(CO)6、Ti(H2O)63+、TiF62-的配體所含原子中電負性最小的是__________;Ti(NO3)4的球棍結構如圖,Ti的配位數是_____________
(5)鈣鈦礦(CaTiO3)是自然界中的一種常見礦物,其晶胞結構如圖:
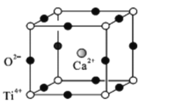
①設N為阿伏加德羅常數的值,計算一個晶胞的質量為______________g.
②假設O2-采用面心立方最密堆積,Ti4+與O2-相切,則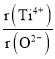 =_________。
=_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物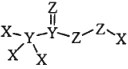 是一種高效消毒劑,其蒸汽和溶液都具有很強的殺菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 為原子序數依次增大的短周期元素。下列敘述正確的是
是一種高效消毒劑,其蒸汽和溶液都具有很強的殺菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 為原子序數依次增大的短周期元素。下列敘述正確的是
A.原子半徑:X>Y>Z
B.元素的非金屬性:X<Y<Z
C.該化合物中Z的化合價均呈-2 價
D.該化合物中 X、Y、Z都滿足 8 電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組數據中,前者剛好是后者兩倍的是 ( )
A. 2 mol H2O的摩爾質量和1 mol H2O的摩爾質量
B. 200 mL 1 mol·L-1氯化鈣溶液中c(Cl-)和100 mL 2 mol·L-1氯化鉀溶液中c(Cl-)
C. 64 g二氧化硫中氧原子數和標準狀況下22.4 L一氧化碳中氧原子數
D. 20% NaOH溶液中NaOH的物質的量濃度和10% NaOH溶液中NaOH的物質的量濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“低碳經濟”備受關注,CO2的捕捉、排集、利用成為科學家研究的重要課題。太空艙產生的 CO2用下列反應捕捉,以實現 O2的循環利用。
Sabatier 反應:CO2(g)+4H2(g)CH4(g)+2H2O(g)
水電解反應:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g)
(1)將原料氣按 n(CO2)∶ n(H2)=1∶4 置于密閉容器中發生 Sabatier 反應,測得H2O(g)的物質的量分數與溫度的關系如圖所示(虛線表示平衡曲線)。
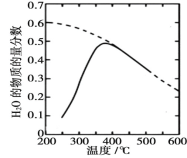
①該反應的平衡常數 K 隨溫度升高而________(填“增大”或“減小”)。
②溫度過高或過低均不利于該反應的進行,原因是________。
③下列措施能提高 CO2 轉化效率的是________(填標號)。
A. 適當減壓
B. 增大催化劑的比表面積
C. 反應器前段加熱,后段冷卻
D. 提高原料氣中 CO2 所占比例
E. 合理控制反應器中氣體的流速
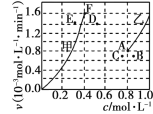
(2)將一定量的 CO2(g)和 CH4(g)通入一恒容密閉容器中發生反應:CO2(g)+CH4(g)2CO(g)+2H2(g) Δ H =+248 kJ·mol-1。
為了探究該反應的反應速率與濃度的關系,起始時向恒容密閉容器中通入CO2 與CH4 ,使其物質的量濃度均為1.0mol·L-1,平衡時,根據相關數據繪制出兩條反應速率與濃度關系曲線如圖, v正~ c(CH4)和 v逆 ~ c(CO)。則與 v正~ c (CH4)相對應曲線是圖中________(填“甲”或“乙”);該反應達到平衡后,某一時刻降低溫度反應重新達到平衡,則此時曲線甲對應的平衡點可能為________(填“D”“E”或“F”)。
(3)用稀氨水噴霧捕集 CO2最終可得產品NH4HCO3。在捕集時,氣相中有中間體 NH2COONH4(氨基甲酸銨)生成。現將一定量純凈的氨基甲酸銨置于恒容密閉容器中,分別在不同溫度下進行反應:NH2COONH4(s) 2NH3(g)+CO2 (g)。實驗測得的有關數據見下表( t1 < t2 < t3 )
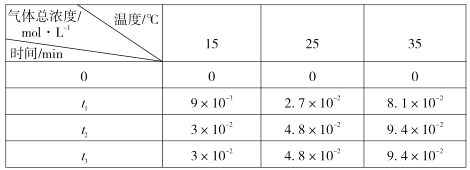
氨基甲酸銨分解反應是________(填“放熱”或“吸熱”)反應。15℃時此反應的化學平衡常數 K =________。
(4)一種新的循環利用方案是用 Bosch 反應 CO2(g)+2H2(g) C(s)+2H2O(g)代替 Sabatier 反應。
① 已知 CO2(g)、H2O(g)的生成焓分別為–394 kJmol-1 、–242 kJmol-1 ,Bosch 反應的Δ H =________kJmol-1(生成焓指一定條件下由對應單質生成 1mol 化合物時的反應熱)。
②一定條件下 Bosch 反應必須在高溫下才能啟動,原因是________。
③該新方案的優點是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學實驗小組設計如下實驗裝置制備SnCl4。
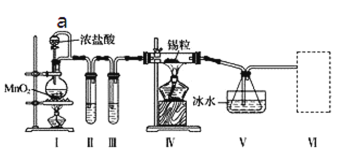
已知:a.金屬錫熔點231 ℃,化學活潑性與鐵相似;
b.干燥的氯氣與熔融金屬錫反應生成SnCl4,SnCl4的沸點114 ℃;
c.SnCl2、SnCl4均易與水蒸氣反應,且Sn2+易被氧化。根據圖甲裝置回答:
(1)導管a的作用是____________________________________,實驗時應先點燃______(填“I”或“IV”)處酒精燈。
(2)Ⅰ處裝置中反應的離子方程式是________,試管Ⅱ中的試劑是____________________,Ⅲ中的試劑是____。
(3)裝置V的作用是_________________,Ⅵ處裝置最好選用________(填字母),其作用是________。
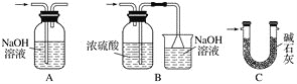
(4)實驗結束后,欲回收利用裝置Ⅰ中未反應完的MnO2,需要的玻璃儀器有______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有含NaCl、Na2SO4和NaNO3的混合物,選擇適當的試劑將其轉化為相應的沉淀或固體,從而實現Cl-、SO42-和NO3-的相互分離。相應的實驗過程可用如圖表示:
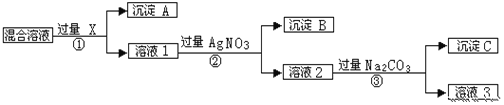
請回答下列問題:
①沉淀A的化學式:________
②過程③中加入過量的Na2CO3的目的是_______________
③按此實驗方案得到的溶液3中比原溶液多了___________離子(填化學式),除去該離子的方法是_________
④為了盡可能完全分離三種離子,步驟①②③過濾后都需要洗滌,請描述洗滌操作_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求完成下列填空:
(1)氫氧化鋁在堿性溶液中的電離方程式為_____。
(2)向FeSO4溶液中加幾滴硫氰化鉀溶液,無現象,再滴加用硫酸酸化過的H2O2,溶液變紅。寫出相應反應的離子方程式_____,_____。
(3)右為某烴的球棍模型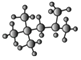 ,其名稱(系統命名法)是_____
,其名稱(系統命名法)是_____
以下寫出相應的化學方程式
(4)鋁粉與二氧化錳混合物在高溫下反應_____
(5)氫氧化亞鐵置于潮濕的空氣中_____
(6)向已酸化的FeCl3溶液中加入銅粉_____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中的一定量混合氣體發生反應:![]() 平衡時測得A的濃度為0.50mol/L,保持溫度不變,將容器的容積擴大到原來的兩倍,再達平衡時,測得A的濃度為0.30mol/L。下列有關判斷正確的是
平衡時測得A的濃度為0.50mol/L,保持溫度不變,將容器的容積擴大到原來的兩倍,再達平衡時,測得A的濃度為0.30mol/L。下列有關判斷正確的是
A.x+y﹤zB.平衡向正反應方向移動
C.B的轉化率降低D.C的體積分數升高
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com