
| A. | 能在水溶液或熔融狀態下導電的物質是電解質 | |
| B. | 電離出氫離子的化合物是酸 | |
| C. | 氧化還原反應中轉移電子數等于得電子數與失電子數加和 | |
| D. | 丁達爾效應可用來區別溶液和膠體 |
分析 A.電解質必須是化合物;
B.酸指電離時產生的陽離子全部都是氫離子的化合物;
C.氧化還原反應中電子轉移是還原劑失去電子給氧化劑;
D.丁達爾效應就是光的散射現象或稱乳光現象.
解答 解:A.電解質必須是化合物,能在水溶液或熔融狀態下導電的化合物是電解質,故A錯誤;
B.酸指電離時產生的陽離子全部都是氫離子的化合物,如NaHSO4溶液中電離出氫離子屬于鹽,故B錯誤;
C.氧化還原反應中電子轉移是還原劑失去電子,氧化劑得到電子,電子轉移是失去電子總數或得到電子總數,不是得電子數與失電子數加和,故C錯誤;
D.丁達爾效應就是光的散射現象或稱乳光現象,可用來區別溶液和膠體,故D正確.
故選D.
點評 本題考查電解質、酸、膠體、氧化還原反應等,題目難度不大,注意知識的積累,掌握基礎是解題關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 只有Fe2+和Cu2+ | B. | 一定有Fe2+、Cu2+,可能有Fe3+ | ||
| C. | 一定有Fe2+,可能有Cu2+ | D. | 只有Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石墨 | B. | 二氧化錳 | C. | 汞 | D. | 鋅 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向100ml濃度均為1mol/LFeI2、FeBr2混合溶液中通入標況下4.48L的氯氣:3Cl2+2Fe2++4I-=2I2+2Fe3++6Cl- | |
| B. | 將1 mol•L-1 NaAlO2溶液和1.5 mol•L-1的HC1溶液等體積混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ | |
| C. | 在澄清石灰水中加入過量的Ca(HCO3)2溶液:2OH-+Ca2++2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | 向NaClO溶液加入少量FeCl2溶液:2Fe2++ClO-+2H+═2Fe3++2H2O+Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

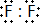 ,兩者氣態氫化物的穩定性是:HF>HCl(填寫化學式).
,兩者氣態氫化物的穩定性是:HF>HCl(填寫化學式).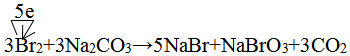 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
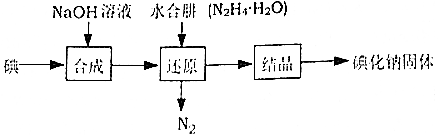
| 規定序號 | 待測體積/mL | 盛裝標準滴定管的起點讀數/mL | 盛裝標準滴定管的終點讀數/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com