
| A. | 該反應的焓變為負值 | |
| B. | 2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常數K1=K2 | |
| C. | 升高溫度,正反應速率增大,逆反應速率減小,平衡正向移動 | |
| D. | 若恒容、恒溫下充入CO,則K值變大 |
分析 衡常數指可逆反應達到平衡時各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值,平衡常數k=$\frac{c(CO)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c(H{\;}_{2})}$,所以該反應化學方程式應為CO2+H2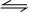 CO+H2O,恒容時,溫度升高,H2 濃度減小,平衡向正反應移動,則該反應為吸熱反應,以此來解答.
CO+H2O,恒容時,溫度升高,H2 濃度減小,平衡向正反應移動,則該反應為吸熱反應,以此來解答.
解答 解:A、恒容時,溫度升高,H2濃度減小,則該反應為吸熱反應,所以△H>0,故A錯誤;
B、由平衡常數可知,該反應為CO2+H2 CO+H2O,所以2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常數K1=K2,故B正確;
CO+H2O,所以2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常數K1=K2,故B正確;
C、升高溫度,正、逆反應速率都增大,正反應速率增大更多,平衡正向移動,故C錯誤;
D、平衡常數僅與溫度有關,所以恒容、恒溫下充入CO,則K值不變,故D錯誤.
故選B.
點評 本題考查化學平衡常數、影響化學平衡的因素等,難度中等,注意對化學平衡常數的理解,同一反應化學計量數不同平衡常數不同.


科目:高中化學 來源: 題型:解答題

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HClO的結構式:H-O-Cl | |
| B. | 質子數為92、中子數為146的U原子:${\;}_{92}^{146}$U | |
| C. | CH2F2的電子式: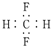 | |
| D. | Cl-的結構示意圖: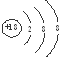 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 直接用酒精燈的外焰加熱蒸發皿 | |
| B. | 加熱過程中不斷用玻璃棒攪拌 | |
| C. | 加熱到液體全部消失 | |
| D. | 蒸發皿中出現多量晶體、少量液體時,停止加熱,利用蒸發皿的余熱烘干 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中最多有4種離子 | B. | 若溶液有顏色,則一定沒有OH-、I- | ||
| C. | 若溶液呈堿性,則一定含有Na+ | D. | 該溶液不可能溶解單質銅 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強電解質在溶液中完全電離,其水溶液中不存在分子 | |
| B. | 同一弱電解質溶液,溫度不同時,導電能力不同 | |
| C. | 強電解質溶液導電能力不一定比弱電解質溶液的導電能力強 | |
| D. | 強電解質在液態時不一定會導電,但在固態時一定不導電 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 31 | B. | 62 | C. | 222 | D. | 142 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com