
| A. |  | B. |  | ||
| C. | 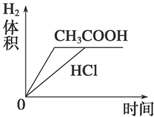 | D. | 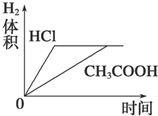 |
分析 HCl是強電解質(zhì),在水溶液中完全電離,CH3COOH是弱電解質(zhì),在水溶液中部分電離,所以pH相同的鹽酸和CH3COOH,c(CH3COOH)>c(HCl),等體積等pH的醋酸和鹽酸中n(CH3COOH)>n(HCl)=0.01mol/L×1L=0.01mol,Mg完全反應需要n(HCl)=$\frac{0.005mol×2}{1}$=0.01mol,所以HCl恰好完全反應,醋酸有剩余;
反應速率與氫離子濃度成正比,氫離子濃度越大,其反應速率越大,據(jù)此分析解答.
解答 解:HCl是強電解質(zhì),在水溶液中完全電離,CH3COOH是弱電解質(zhì),在水溶液中部分電離,所以pH相同的鹽酸和CH3COOH,c(CH3COOH)>c(HCl),等體積等pH的醋酸和鹽酸中n(CH3COOH)>n(HCl)=0.01mol/L×1L=0.01mol,Mg完全反應需要n(HCl)=$\frac{0.005mol×2}{1}$=0.01mol,所以HCl恰好完全反應,醋酸有剩余;
A.因為醋酸有剩余,鹽酸恰好完全反應,所以反應后的溶液pH醋酸<鹽酸,故A錯誤;
B.開始時兩種溶液中氫離子濃度相等,所以其反應速率相等;反應過程中,醋酸繼續(xù)電離出氫離子,導致醋酸溶液中氫離子濃度大于鹽酸,所以醋酸反應速率大于鹽酸,故B錯誤;
C.因為醋酸有剩余、鹽酸恰好完全反應,與兩種酸反應的Mg質(zhì)量相同,所以生成氫氣的體積相同,因為醋酸反應速率大,所以完全反應時醋酸反應的時間短,故C正確;
D.根據(jù)C知,圖象D錯誤,故D錯誤;
故選C.
點評 本題考查弱電解質(zhì)的電離,為高頻考點,側(cè)重考查學生圖象分析及計算能力,明確弱電解質(zhì)電離特點及物質(zhì)之間的關(guān)系是解本題關(guān)鍵,注意B中反應速率與氫離子濃度有關(guān),與電解質(zhì)強弱無關(guān),題目難度不大.


 名校通行證有效作業(yè)系列答案
名校通行證有效作業(yè)系列答案科目:高中化學 來源:2016-2017學年西藏拉薩中學高二上第一次月考化學試卷(解析版) 題型:選擇題
在一定的條件下,CO與CH4燃燒的熱化學方程式分別為
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/m ol
ol
由1molCO和3molCH4組成的混和氣在上述條件下完全燃燒時,釋放的熱量為
A.2953kJ B.2912kJ C.3236kJ D.3867kJ
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
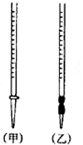 用中和滴定法測定某燒堿樣品的純度.有以下步驟:
用中和滴定法測定某燒堿樣品的純度.有以下步驟:| 測定序號 | 待測溶液的體積(mL) | 所耗鹽酸標準液的體積(mL) | |
| 滴定前讀數(shù) | 滴定后讀數(shù) | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 0.40 | 21.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稱取4.77g Na2CO3固體溶于水配成450mL溶液 | |
| B. | 稱取5.3g Na2CO3固體溶于水配成500mL溶液 | |
| C. | 稱取12.9g Na2CO3•10H2O 固體溶于水配成450mL溶液 | |
| D. | 量取90mL 0.5mol/L Na2CO3溶液加360mL水稀釋 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
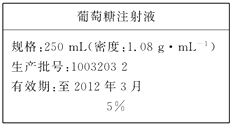 為維持人體血液中的血糖含量,在給病人輸液時,通常用葡萄糖注射液,下頁圖是醫(yī)院給病人輸液時使用的一瓶質(zhì)量分數(shù)為5%的葡萄糖(C6H12O6)注射液的標簽.某學生欲在實驗室中配制500mL該葡萄糖注射液.
為維持人體血液中的血糖含量,在給病人輸液時,通常用葡萄糖注射液,下頁圖是醫(yī)院給病人輸液時使用的一瓶質(zhì)量分數(shù)為5%的葡萄糖(C6H12O6)注射液的標簽.某學生欲在實驗室中配制500mL該葡萄糖注射液.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com