
 氮、硫、氯及其化合物是中學化學重要的組成部分.
氮、硫、氯及其化合物是中學化學重要的組成部分.分析 (1)依據化學方程式分析氨氣化合價變化,判斷發生氧化反應的物質是氨氣,原電池中在負極失電子,正極上氧氣得到電子生成氫氧根離子;用氨燃料電池進行粗銅(含Al、Zn、Ag、Pt、Au等雜質)的電解精煉,電解液為CuSO4溶液,陽極上Cu以及比銅活潑的金屬放電,陰極上銅離子放電;
(2)①(2)實現固體和液體的分離可以采用過濾的方法;硫酸鋇和鹽酸不反應,但是亞硫酸鋇可以和鹽酸反應;
②電解池中吸收工業尾氣中SO2,陰極上生成Cu,陽極是二氧化硫失電子發生氧化反應生成硫酸根離子;
(3)硫酸鋇中加入飽和碳酸鈉溶液,發生沉淀轉化生成碳酸鋇沉淀,依據化學反應的離子方程式書寫平衡常數,結合鋇離子濃度相同得到平衡常數的計算式為溶度積常數比值,代入數值計算.
解答 解:(1)電池反應為:4NH3+3O2=2N2+6H2O.該電池負極是氨氣失電子生成氮氣,反應的電極反應式為2NH3+6OH--6e-=N2+6H2O,
用氨燃料電池電解CuSO4溶液,陽極上氫氧根離子放電,陰極上銅離子放電而析出銅,陽極上電極反應式為:4OH--4e-=O2↑+2H2O,
a、電解池中是電能轉化為化學能,但不可能完全轉化,故錯誤;
b、硫酸根離子不參與反應,所以濃度不變,故正確;
c、電解池中陽離子移向陰極,故錯誤;
d、陽極上Cu以及比銅活潑的金屬放電,Ag、Pt、Au等金屬留在陽極泥里,故正確;
e、陽極上Cu以及比銅活潑的金屬放電,所以若陽極質量減少64g,則轉移電子數不是2NA個,故錯誤;
故答案為:2NH3+6OH--6e-=N2+6H2O;bd;
(2)①將SO2通入到BaCl2溶液中,出現的白色渾濁可能是硫酸鋇還可能是亞硫酸鋇,硫酸鋇和鹽酸不反應,但是亞硫酸鋇可以和鹽酸反應,溶解,可以用鹽酸來鑒別沉淀成分,故答案為:HCl;2SO2+2Ba2++O2+2H2O═2BaSO4↓+4H+;
②電解池中吸收工業尾氣中SO2,陰極上生成Cu,陽極是二氧化硫失電子發生氧化反應生成硫酸根離子,電極反應為:SO2+2H2O-2e-=4H++SO42-;
故答案為:SO2+2H2O-2e-=4H++SO42-;
(3)硫酸鋇中加入飽和碳酸鈉溶液,發生沉淀轉化生成碳酸鋇沉淀,反應的離子方程式為:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq),則平衡常數=$\frac{c(S{O}_{{4}^{2-}})}{c(C{O}_{{3}^{2-}})}$=$\frac{c(S{{O}_{4}}^{2-})•c(B{a}^{2+})}{c(C{{O}_{3}}^{2-})•c(B{a}^{2+})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1×1{0}^{-10}}{2.5×1{0}^{-9}}$=0.04;
故答案為:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq);0.04.
點評 本題主要考查了氧化還原反應、離子方程式式的書寫以及化學計算,題目難度中等,注意沉淀轉化關系的分析判斷,電解池原理應用,掌握基礎是關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.44 s | B. | 2 s | C. | 0.33 s | D. | 1 s |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該晶體中一定含有SCN- | |
| B. | Fe3+的氧化性比Br2的氧化性強 | |
| C. | Fe2+被Br2氧化為Fe3+ | |
| D. | Fe2+ 與SCN-不能形成血紅色的化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加熱金屬鋁使之融化 | B. | 液氨受熱蒸發 | ||
| C. | 加熱碘化氫氣體使之分解 | D. | 加熱硅晶體使之融化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將SO2分別通入BaCl2、Ba(NO3)2溶液中,都會觀察到有白色沉淀生成 | |
| B. | 檢驗某酸性溶液中Cl-、SO42-,選用試劑及順序是過量的AgNO3溶液、Ba(NO3)2溶液 | |
| C. | 純鋅與稀硫酸反應產生氫氣的速率較慢,加入少量硫酸銅固體后,反應速率會加快 | |
| D. | 對于任意化學平衡,只要增大反應物濃度,都會使反應物轉化率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
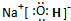 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
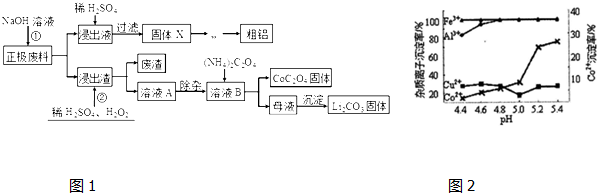
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電池的電解液可為LiCl水溶液 | |
| B. | 該電池放電時,負極發生還原反應 | |
| C. | 放電時正極反應式為:2SOCl2+4e-=4Cl-+S+SO2 | |
| D. | 放電時電子從負極經外電路流向正極,再從正極經電解質流向負極 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com