
分析 (1)依據題干可知Na2C03和Na2S以1:2的物質的量之比混合,再通入二氧化硫發生反應生成Na2S2O3和二氧化碳,依據原子個數守恒、得失電子守恒書寫方程式;
依據過氧化鈉結構結合氧原子、硫原子結構解答;
(2)酸性環境下S2O32-發生歧化反應,消耗的硫代硫酸根鈉偏多,測定結果會偏高;
(3)工業上用大蘇打溶液吸收工業廢氣中的氯氣,其氧化產物為SO42-,離子反應方程式為:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(4)將硫酸鈣轉化為易除的碳酸鈣;
(5)Na2O2與足量的NaHCO3混合后,在密閉容器中充分加熱,可能發生的反應有:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,殘留固體為純凈物,則為碳酸鈉,由此分析解答.
解答 解:(1)依據題干可知Na2C03和Na2S以1:2的物質的量之比混合,再通入二氧化硫發生反應生成Na2S2O3和二氧化碳,反應中S元素的化合價從-2價升高到+2價,S的化合價從+4價降低到+2價,依據原子個數守恒、得失電子守恒反應的方程式:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;
Na2S溶液在空氣中長期放置,和氧氣反應生成與過氧化鈉的結構及化學性質相似的物質Na2S2;
故答案為:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;Na2S2;
(2)酸性環境下S2O32-發生歧化反應,離子方程式:S2O32-+2H+=S↓+H2O+SO2↑,故答案為:S2O32-+2H+=S↓+H2O+SO2↑;
(3)工業上用大蘇打溶液吸收工業廢氣中的氯氣,其氧化產物為SO42-,離子反應方程式為:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;故答案為:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(4)將硫酸鈣轉化為易除的碳酸鈣,離子反應方程式為:將CaSO4轉化為CaCO3,CaSO4+CO32-=CaCO3+SO42-,故答案為:將CaSO4轉化為CaCO3,CaSO4+CO32-=CaCO3+SO42-;
(5)Na2O2與足量的NaHCO3混合后,在密閉容器中充分加熱,可能發生的反應有:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,殘留固體為純凈物,則為碳酸鈉,則n(NaHCO3):n(Na2O2)≥2,故答案為:≥2.
點評 本題考查了氧化還原反應,側重考查氧化還原反應方程式的書寫,明確氧化還原反應得失電子守恒規律是解題關鍵,題目難度中等.


 口算題卡河北少年兒童出版社系列答案
口算題卡河北少年兒童出版社系列答案 A加金題 系列答案
A加金題 系列答案 全優測試卷系列答案
全優測試卷系列答案科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③④① | B. | ④②③① | C. | ④③①② | D. | ②①③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑤ | B. | ④⑥ | C. | ①④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 現象或事實 | 解釋 |
| A | 已知水熱反應是指在高溫高壓下,將二氧化碳轉化為有機物的技術 | 水熱反應可以降低自然界中碳的含量 |
| B | 用鋁制易拉罐收集滿CO2,加入過量NaOH濃溶液,立即把口封閉.發現易拉罐“咔咔”作響并變癟了,過了一會兒,易拉罐又會作響并鼓起來 | 導致易拉罐又鼓起來的反應是: Al3++3HCO3-=Al(OH)3+3CO2↑ |
| C | FeCl3溶液可用于制作銅質印刷線路板的“爛板液” | FeCl3溶液能將銅氧化為Cu2+ |
| D | 用浸泡過高錳酸鉀溶液的硅藻土吸收水果產生的乙烯以達到保鮮目的 | 乙烯能夠與高錳酸鉀溶液發生加成反應,從而起到去除乙烯的目的 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
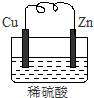 由銅片、鋅片和200ml稀H2SO4組成的原電池中,一段時間后某極產生3.36L(標準狀況)的氣體.
由銅片、鋅片和200ml稀H2SO4組成的原電池中,一段時間后某極產生3.36L(標準狀況)的氣體.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
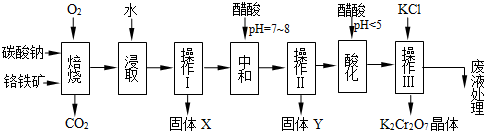
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
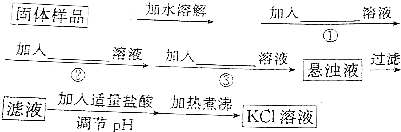
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com