
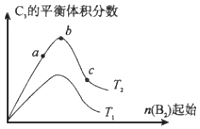
分析 (1)該反應中如果有2molA2完全反應,則放出Q1kJ熱量,則放出Q2kJ熱量時消耗n(A2)=$\frac{{Q}_{2}}{{Q}_{1}}×2mol$,A2的轉化率=$\frac{\frac{{Q}_{2}}{{Q}_{1}}×2mol}{2mol}$;
(2)達到平衡后,若向原容器中通入少量的氬氣,容器體積不變,則反應物和生成物濃度不變,平衡不移動;
(3)相同溫度下,若在原來的容器中,只加入2mol C3,如果加入2molA2和1molB2是等效平衡,兩種情況下達到平衡狀態時兩個容器中C3濃度相等;
相同條件下,2mol C3達到平衡狀態時,與加入2mol A2和1mol B2達建立完全相同的平衡狀態,即從化學平衡狀態到完全反應生成2molC3,兩個容器中放出熱量之和等于Q1;
(4)a.相同溫度下,反應物濃度越大,反應速率越大;
b.相同溫度下,B2的物質的量越大,達到平衡時A2的轉化率越大;
c.該反應的正反應是放熱反應,升高溫度平衡逆向移動,生成物體積分數減小;
d.當反應物的物質的量之比等于其計量數之比時,生成物的體積分數最大;
(5)該反應前后氣體物質的量減小,壓強減小,如果是在恒壓條件下進行反應,相當于增大壓強,平衡正向移動,則反應物的轉化率增大;
(6)a.選擇適當的催化劑,只增大反應速率但平衡不移動;
b.增大壓強,正逆反應速率都增大,平衡向氣體體積減小的方向移動;
c.及時分離生成的C3,平衡正向移動,但反應速率減小;
d.升高溫度,平衡逆向移動.
解答 解:(1)該反應中如果有2molA2完全反應,則放出Q1kJ熱量,則放出Q2kJ熱量時消耗n(A2)=$\frac{{Q}_{2}}{{Q}_{1}}×2mol$,A2的轉化率=$\frac{\frac{{Q}_{2}}{{Q}_{1}}×2mol}{2mol}$=$\frac{{Q}_{2}}{{Q}_{1}}$,
故答案為:$\frac{{Q}_{2}}{{Q}_{1}}$;
(2)達到平衡后,若向原容器中通入少量的氬氣,容器體積不變,則反應物和生成物濃度不變,平衡不移動,則A2的轉化率不變,故答案為:不變;
(3)相同溫度下,若在原來的容器中,只加入2mol C3,如果加入2molA2和1molB2是等效平衡,兩種情況下達到平衡狀態時兩個容器中C3濃度相等,所以C3濃度=wmol/L;
相同條件下,2mol C3達到平衡狀態時,與加入2mol A2和1mol B2達建立完全相同的平衡狀態,即從化學平衡狀態到完全反應生成2molC3,兩個容器中放出熱量之和等于Q1,所以Q3=Q1-Q2,
故答案為:=;Q1-Q2;
(4)a.相同溫度下,反應物濃度越大,反應速率越大,所以反應速率c>b>a,故正確;
b.相同溫度下,B2的物質的量越大,達到平衡時A2的轉化率越大,所以轉化率c>b>a,故錯誤;
c.該反應的正反應是放熱反應,升高溫度平衡逆向移動,生成物體積分數減小,所以T2<T1
,故錯誤;
d.當反應物的物質的量之比等于其計量數之比時,生成物的體積分數最大,所以b點A2和B2的物質的量之比為2:1,故正確;
故選ad;
(5)該反應前后氣體物質的量減小,壓強減小,如果是在恒壓條件下進行反應,相當于增大壓強,平衡正向移動,則反應物的轉化率增大,所以Q2<Q4,故答案為:<;
(6)a.選擇適當的催化劑,只增大反應速率但平衡不移動,不符合條件,故錯誤;
b.增大壓強,正逆反應速率都增大,平衡向氣體體積減小的方向移動,平衡正向移動,符合條件,故正確;
c.及時分離生成的C3,平衡正向移動,但反應速率減小,不符合條件,故錯誤;
d.該反應的正反應是放熱反應,升高溫度,平衡逆向移動,不符合條件,故錯誤;
故選b.
點評 本題考查化學平衡計算、化學平衡影響因素等知識點,側重考查學生分析判斷能力,明確等效平衡及正確構建等效平衡是解本題關鍵,注意:(4)d中反應物物質的量之比等于計量數之比時產物的含量最大,為易錯點.


 快捷英語周周練系列答案
快捷英語周周練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生物質能的缺點是嚴重污染環境 | |
| B. | 生物質能源是可再生的能源 | |
| C. | 利用生物質能就是間接利用太陽能 | |
| D. | 使用沼氣這種生物質能是對化學能的充分利用 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 中和時所需NaOH的量 | B. | 與Mg反應的起始速率 | ||
| C. | OH-的物質的量濃度 | D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若將容器壓縮時,正逆反應速率均不變 | |
| B. | 5 min內平均反應速率v(X)=0.02 mol/(L•min) | |
| C. | 向平衡后的體系中加入l molM(s),平衡向逆反應方向移動 | |
| D. | 當混合氣體的質量不再發生變化時,說明反應達到平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 氨在生活、生產、科研中有廣泛用途.
氨在生活、生產、科研中有廣泛用途.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
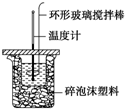 利用如圖所示裝置測定中和熱的實驗步驟如下:
利用如圖所示裝置測定中和熱的實驗步驟如下:| 實驗 序號 | 起始溫度t1/℃ | 終止溫度t2/℃ | |
| 鹽酸 | 氫氧化鈉溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com