
(6分) 某同學(xué)欲配制250 mL 2 mol·L-1 的碳酸鈉溶液,并進行有關(guān)實驗。請回答下列問題:
(1)需稱量無水碳酸鈉的質(zhì)量 g。
(2)配制該碳酸鈉溶液時使用的儀器除天平(帶砝碼)、燒杯、玻璃棒外,還必須用到的儀器有 、 等。
(3)取所配制的碳酸鈉溶液125 mL,向其加入125 mL 3mol·L-1 的硫酸溶液,待充分反應(yīng)后,生成的氣體在標準狀況下所占的體積為(假設(shè)產(chǎn)生的氣體全部逸出) ;設(shè)反應(yīng)后溶液的體積為250mL,則反應(yīng)后溶液中Na+的物質(zhì)的量濃度為 。
(1)5.3 (2)容量瓶(250mL)、膠頭滴管 (3)5.6L、2 mol·L-1
【解析】
試題分析:(1)n(Na2CO3)=0.025L×2mol/L=0.05mol,m(Na2CO3)= 0.05mol×106g/mol=5.3g。
(2)配制溶液除使用天平(帶砝碼)、燒杯、玻璃棒外,還必須用到的儀器有250mL容量瓶和膠頭滴管。
(3)根據(jù)Na2CO3+H2SO4=Na2SO4+CO2+H2O反應(yīng)可知,硫酸過量,所以產(chǎn)生氣體的體積由Na2CO3的量決定。設(shè)產(chǎn)生CO2 xmol
Na2CO3+H2SO4=Na2SO4+CO2+H2O
1 1
0.125×2 x
則x=0.25mol,體積為0.25mol×22.4mol/L=5.6L。
根據(jù)Na+守恒,可知溶液中有Na+0.5mol,所以c(Na+)=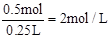
考點:物質(zhì)的量濃度計算
點評:本題基礎(chǔ)簡單


 周周清檢測系列答案
周周清檢測系列答案 輕巧奪冠周測月考直通高考系列答案
輕巧奪冠周測月考直通高考系列答案科目:高中化學(xué) 來源:2012-2013學(xué)年山東省泰安市高三第一次月考化學(xué)試卷(解析版) 題型:實驗題
(11分)某學(xué)生欲配制6.0 mol/L的H2SO4 1 000 mL,實驗室有三種不同濃度的硫酸:
①480 mL 0.5 mol/L 的硫酸;②150 mL 25%的硫酸(ρ=1.18 g/mL);③足量的18 mol/L的硫酸。有三種規(guī)格的容量瓶:250 mL、500 mL、1 000 mL。老師要求把①②兩種硫酸全部用完,不足的部分由③來補充。
請回答下列問題:
(1)實驗所用25%的硫酸的物質(zhì)的量濃度為______mol/L(保留1位小數(shù))。
(2)配制該硫酸溶液應(yīng)選用容量瓶的規(guī)格為______mL。
(3)配制時,該同學(xué)的操作順序如下,請將操作步驟B、D補充完整。
A.將①②兩溶液全部在燒杯中混合均勻;
B.用量筒準確量取所需的18 mol/L的濃硫酸____mL,沿玻璃棒倒入上述混合液中。并用玻璃棒攪拌,使其混合均勻;
C.將混合均勻的硫酸沿玻璃棒注入所選的容量瓶中;
D._________________________________________________________________
_________________________________________________________________
E.振蕩,繼續(xù)向容量瓶中加水,直到液面接近刻度線1~2 cm 處;
F.改用膠頭滴管加水,使溶液的凹液面恰好與刻度線相切;
G.將容量瓶蓋緊,振蕩,搖勻。
(4)如果省略操作D,對所配溶液濃度有何影響?________(填“偏大”、“偏小”或“無影響”)。
(5)進行操作C前還需注意
。
查看答案和解析>>
科目:高中化學(xué) 來源:2011-2012年河南省高二上學(xué)期10月份月考化學(xué)試卷 題型:實驗題
(14分).酸堿中和滴定是中學(xué)化學(xué)常見實驗。
Ⅰ右圖表示50mL酸式滴定管中液面的位置,如果液面處的讀數(shù)是a,則滴定管中剩余液體的體積是______mL
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ 某同學(xué)欲測定某濃硫酸樣品的物質(zhì)的量濃度,進行了以下實驗操作:
A.冷卻至室溫后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于錐形瓶中并滴入幾滴指示劑。
C.將酸式滴定管和堿式滴定管用蒸餾水洗滌干凈,并用各待盛溶液潤洗。
D.將物質(zhì)的量濃度為1.50mol·L-1標準NaOH溶液裝入堿式滴定管,調(diào)節(jié)液面記下讀數(shù)V1。
E.繼續(xù)滴定至終點,記下讀數(shù)為V2。
F.在錐形瓶下墊一張白紙,把錐形瓶移到堿式滴定管下小心滴入NaOH標準溶液,邊滴邊搖動錐形瓶。
G.量取濃硫酸樣品5mL,在燒杯中用蒸餾水溶解。
H.重復(fù)以上實驗。
請回答下列問題:
(1)該實驗正確操作步驟的順序為 → A→ → →D→ → → H(用編號字母填寫)。
(2)量取5mL濃硫酸的儀器是 ;量取20.00mL稀硫酸的儀器是 。
(3)選用的指示劑是 。滴定過程中,視線應(yīng)注視 ;判斷到達滴定終點的現(xiàn)象是 。
(4)下表是實驗測得的有關(guān)數(shù)據(jù):
|
滴定序號 |
待測稀硫酸的體積(mL) |
所消耗NaOH標準溶液液的體積(mL) |
|
|
V1 |
V2 |
||
|
① |
20.00 |
0.50 |
22.60 |
|
② |
20.00 |
6.00 |
27.90 |
請計算出該濃硫酸樣品的濃度為 mol·L-1(不必寫出計算過程)。
查看答案和解析>>
科目:高中化學(xué) 來源:2013屆河南省商丘市高二第一學(xué)期第二次月考化學(xué)試卷 題型:實驗題
(9分)酸堿中和滴定是中學(xué)化學(xué)常見實驗。
某同學(xué)欲測定某濃硫酸樣品的物質(zhì)的量濃度,進行了以下實驗操作:
A.冷卻至室溫后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于錐形瓶中并滴入幾滴指示劑。
C.將酸式滴定管和堿式滴定管用蒸餾水洗滌干凈,并用各待盛溶液潤洗。
D.將物質(zhì)的量濃度為1.50mol/L標準NaOH溶液裝入堿式滴定管,調(diào)節(jié)液面記下讀數(shù)V1。
E.繼續(xù)滴定至終點,記下讀數(shù)為V2。
F.在錐形瓶下墊一張白紙,把錐形瓶移到堿式滴定管下小心滴入NaOH標準溶液,邊滴邊搖動錐形瓶。
G.量取濃硫酸樣品5mL,在燒杯中用蒸餾水稀釋。
H.重復(fù)以上實驗。
請回答下列問題:
(1)該實驗正確操作步驟的順序為 → A→ → →D→ → → H
(用編號字母填寫)。
(2)量取5mL濃硫酸的儀器是 ;量取20.00mL稀硫酸的儀器是 。
(3)選用的指示劑是 。滴定過程中,視線應(yīng)注視 ;判斷到達滴定終點的現(xiàn)象是 。
(4)下表是實驗測得的有關(guān)數(shù)據(jù):
|
滴定序號 |
待測稀硫酸的體積(mL) |
所消耗NaOH標準溶液液的體積(mL) |
|
|
V1 |
V2 |
||
|
① |
20.00 |
0.50 |
22.60 |
|
② |
20.00 |
6.00 |
27.90 |
請計算出該濃硫酸樣品的濃度為 mol·L-1(不必寫出計算過程)。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:閱讀理解
(14分).酸堿中和滴定是中學(xué)化學(xué)常見實驗。
Ⅰ右圖表示50mL酸式滴定管中液面的位置,如果液面處的讀數(shù)是a,則滴定管中剩余液體的體積是______mL
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ 某同學(xué)欲測定某濃硫酸樣品的物質(zhì)的量濃度,進行了以下實驗操作:
A.冷卻至室溫后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于錐形瓶中并滴入幾滴指示劑。
C.將酸式滴定管和堿式滴定管用蒸餾水洗滌干凈,并用各待盛溶液潤洗。
D.將物質(zhì)的量濃度為1.50mol·L-1標準NaOH溶液裝入堿式滴定管,調(diào)節(jié)液面記下讀數(shù)V1。
E.繼續(xù)滴定至終點,記下讀數(shù)為V2。
F.在錐形瓶下墊一張白紙,把錐形瓶移到堿式滴定管下小心滴入NaOH標準溶液,邊滴邊搖動錐形瓶。
G.量取濃硫酸樣品5mL,在燒杯中用蒸餾水溶解。
H.重復(fù)以上實驗。
請回答下列問題:
(1)該實驗正確操作步驟的順序為 → A→ → →D→ → → H(用編號字母填寫)。
(2)量取5mL濃硫酸的儀器是 ;量取20.00mL稀硫酸的儀器是 。
(3)選用的指示劑是 。滴定過程中,視線應(yīng)注視 ;判斷到達滴定終點的現(xiàn)象是 。
(4)下表是實驗測得的有關(guān)數(shù)據(jù):
| 滴定序號 | 待測稀硫酸的體積(mL) | 所消耗NaOH標準溶液液的體積(mL) | |
| V1 | V2 | ||
| ① | 20.00 | 0.50 | 22.60 |
| ② | 20.00 | 6.00 | 27.90 |
請計算出該濃硫酸樣品的濃度為 mol·L-1(不必寫出計算過程)。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
(9分)酸堿中和滴定是中學(xué)化學(xué)常見實驗。
某同學(xué)欲測定某濃硫酸樣品的物質(zhì)的量濃度,進行了以下實驗操作:
A.冷卻至室溫后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于錐形瓶中并滴入幾滴指示劑。
C.將酸式滴定管和堿式滴定管用蒸餾水洗滌干凈,并用各待盛溶液潤洗。
D.將物質(zhì)的量濃度為1.50mol/L標準NaOH溶液裝入堿式滴定管,調(diào)節(jié)液面記下讀數(shù)V1。
E.繼續(xù)滴定至終點,記下讀數(shù)為V2。
F.在錐形瓶下墊一張白紙,把錐形瓶移到堿式滴定管下小心滴入NaOH標準溶液,邊滴邊搖動錐形瓶。
G.量取濃硫酸樣品5mL,在燒杯中用蒸餾水稀釋。
H.重復(fù)以上實驗。
請回答下列問題:
(1)該實驗正確操作步驟的順序為 →A→ → →D→ → → H
(用編號字母填寫)。
(2)量取5mL濃硫酸的儀器是 ;量取20.00mL稀硫酸的儀器是 。
(3)選用的指示劑是 。滴定過程中,視線應(yīng)注視 ;判斷到達滴定終點的現(xiàn)象是 。
(4)下表是實驗測得的有關(guān)數(shù)據(jù):
| 滴定序號 | 待測稀硫酸的體積(mL) | 所消耗NaOH標準溶液液的體積(mL) | |
| V1 | V2 | ||
| ① | 20.00 | 0.50 | 22.60 |
| ② | 20.00 | 6.00 | 27.90 |
請計算出該濃硫酸樣品的濃度為 mol·L-1(不必寫出計算過程)。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com