
| X | Y | ||
| W | Z |
| A. | X、Y、Z三種元素最低價氫化物的沸點依次升高 | |
| B. | 由X、Z和氫三種元素形成的化合物中只有共價鍵 | |
| C. | 原子半徑的大小順序:r(X)>r(Y)>r(W)>r(Z) | |
| D. | X的最高價氧化物對應的水化物的酸性比W的強 |
分析 W、X、Y、Z為短周期元素,由元素在周期表中位置可知,X、Y處于第二周期,W、Z處于第三周期,設W的最外層電子數為x,則X、Y、Z最外層電子數分別為x+1、x+2、x+3,故x+x+1+x+2+x+3=22,解得:x=4,故W為Si、X為N、Y為O、Z為Cl元素,據此解答.
解答 解:W、X、Y、Z為短周期元素,由元素在周期表中位置可知,X、Y處于第二周期,W、Z處于第三周期,設W的最外層電子數為x,則X、Y、Z最外層電子數分別為x+1、x+2、x+3,故x+x+1+x+2+x+3=22,解得:x=4,故W為Si、X為N、Y為O、Z為Cl元素,
A.X、Y、Z三種元素最低價氫化物分別為氨氣、水、HCl,常溫下水為液態,氨氣、HCl為氣體,故水的沸點最高,氨氣分子之間都存在氫鍵,沸點比HCl的高,故A錯誤;
B.N、O和H形成的化合物為NH4NO3,既含有離子鍵、又有共價鍵,故B錯誤;
C.同周期自左而右原子半徑減小,電子層越多原子半徑越大,故原子半徑:r(W)>r(Z)>r(X)>r(Y),故C錯誤;
D.元素的非金屬性越強,其最高價氧化物對應的水合物的酸性越強,故硝酸的酸性比硅酸的強,故D正確,
故選:D.
點評 本題考查結構性質位置關系應用,推斷元素是解題關鍵,注意對元素周期律的理解應用,難度中等.


科目:高中化學 來源: 題型:解答題
| 物質 | 熔點/℃ | 沸點/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
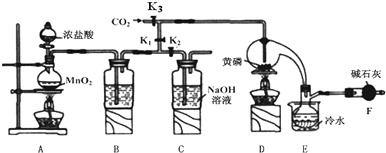
 的路線如圖所示.請按要求作答
的路線如圖所示.請按要求作答
 .
. ,F
,F .
. ,
, .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | ①用銅和濃硝酸制取少量NO2 | B. | ②比較S、C、Si的非金屬性 | ||
| C. | ③驗證HCl溶解性 | D. | ④用于吸收NH3尾氣,并防止倒吸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3具有還原性 | B. | H-是很強的還原劑 | ||
| C. | H2是氧化產物,NH2$_2^-$是還原產物 | D. | 該反應屬于置換反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10mL 18mol/L濃硫酸與足量銅加熱充分反應,其中有0.09NA個H2SO4體現了氧化性 | |
| B. | 33.6LCl2一定能與56g鐵在加熱條件下發生反應 | |
| C. | 12.0g熔融的NaHSO4中含有的陽離子數為0.2NA | |
| D. | 在反應14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2發生反應,有21NA個電子發生轉移 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0 | B. | 1 | C. | 2 | D. | 3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com