
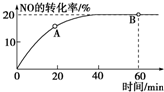
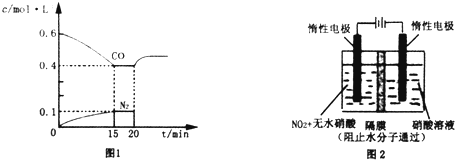
 (1)某溫度下,向容積為1L的容器中充入3mol NO和1mol CO,發生2NO(g)+2CO(g)???N2(g)+2CO2(g)反應,NO的轉化率隨時間的變化如圖所示.
(1)某溫度下,向容積為1L的容器中充入3mol NO和1mol CO,發生2NO(g)+2CO(g)???N2(g)+2CO2(g)反應,NO的轉化率隨時間的變化如圖所示.分析 (1))①該溫度下,由圖象可知達到平衡時NO轉化率為20%,則NO轉化的物質的量為:3mol×20%=0.6mol,根據反應2NO(g)+2CO(g)═N2(g)+2CO2(g)可知:CO轉化了0.6mol,反應生成氮氣、二氧化碳分別為0.3mol,0.6mol,則平衡時各物質濃度分別為:c(NO)=$\frac{3mol-0.6mol}{1L}$=2.4mol/L、c(CO)=$\frac{1mol-0.6mol}{1L}$=0.4mol/L、c(N2)=$\frac{0.3mol}{1L}$=0.3mol/L、c(CO2)=$\frac{0.6mol}{1L}$=0.6mol/L,然后根據化學平衡常數表達式計算即可;平衡時CO的轉化率=$\frac{反應轉化的物質的量}{反應前總物質的量}$×100%;
②根據隨著反應時行反應物濃度減小,反應速率減小判斷A點的逆反應速率逆V逆(CO)與B點的逆反應速率V逆(NO)大小;
(2)①1g液態肼完全反應生成氣態水放出的熱量為20kJ,據此書寫熱化學風程式;結合寫出的熱化學方程式和誰轉化的熱化學方程式,根據蓋斯定律合并寫出生成液態水時的熱化學方程式進行計算;
②化學反應中,化學鍵斷裂吸收能量,形成新化學鍵放出能量,化學反應的焓變=舊鍵斷裂吸收的能量-新鍵生成釋放的能量.
解答 解:(1)①該溫度下,由圖象可知達到平衡時NO轉化率為20%,則NO轉化的物質的量為:3mol×20%=0.6mol,根據反應2NO(g)+2CO(g)═N2(g)+2CO2(g)可知:CO轉化了0.6mol,反應生成氮氣、二氧化碳分別為0.3mol,0.6mol,則平衡時各物質濃度分別為:c(NO)=$\frac{3mol-0.6mol}{1L}$=2.4mol/L、c(CO)=$\frac{1mol-0.6mol}{1L}$=0.4mol/L、c(N2)=$\frac{0.3mol}{1L}$=0.3mol/L、c(CO2)=$\frac{0.6mol}{1L}$=0.6mol/L,
將數據代入化學平衡常數表達式可得:K=$\frac{0.3×0.{6}^{2}}{2.{4}^{2}×0.{4}^{2}}$=$\frac{15}{128}$;
平衡時CO的轉化率為:$\frac{0.6mol}{1mol}$×100%=60%,
故答案為:$\frac{15}{128}$;60%;
②由于隨著反應時行反應物濃度減小,速率減小,故A點的逆反應速率逆V逆(CO)小于B點的逆反應速率V逆(NO),
故答案為:<;
(2)①1g液態肼完全反應生成氣態水放出的熱量為20kJ,所以1mol即32g液態肼完全反應生成氣態水放出的熱量為640kJ,即①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol;②H2O(g)=H2O(l)△H=-44kJ/mol;
依據蓋斯定律①+②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l);△H=-816kJ/mol,
故答案為:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l);△H=-816kJ/mol;
②由N2、H2合成氣態肼(N2H4)的反應為:N2(g)+2H2(g)═N2H4(g)焓變=946kJ•mol-1+2(436kJ•mol-1)-[4(390.8kJ•mol-1)+193kJ•mol-1]=+61.8 kJ•mol-1,故答案為:N2(g)+2H2(g)═N2H4(g)△H=+61.8 kJ•mol-1.
點評 本題考查了化學平衡的計算、反應熱計算,題目難度中等,明確化學平衡及其影響為解答關鍵,注意掌握化學鍵斷裂、形成中的能力變化與焓變之間的關系,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源:2017屆吉林省高三上第二次模擬化學試卷(解析版) 題型:選擇題
下列說法正確的是
A.(CH3)3CCH2(CH3)C=CH2的名稱為:2,2,4-三甲基-4-戊烯
B.碳原子數小于或等于8的單烯烴,與HBr加成反應的產物只有一種結構,符合條件的單烯烴有6種(不考慮順反異構)
C.1mol有機物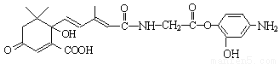 與NaOH溶液反應,最多消耗5molNaOH
與NaOH溶液反應,最多消耗5molNaOH
D.1molβ-紫羅蘭酮(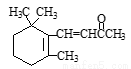 )與1molHBr發生加成反應可得到3種不同產物
)與1molHBr發生加成反應可得到3種不同產物
查看答案和解析>>
科目:高中化學 來源:2017屆廣東省山一高三上第二次統測化學試卷(解析版) 題型:選擇題
下列關于物質的用途正確的是( )
A.在醫療上碳酸鈉、Al(OH)3均可用于治療胃酸過多
B.人造剛玉的熔點很高,可用作高級耐火材料,其主要成分是SiO2
C.水玻璃可用于生產粘合劑和防火劑
D.自來水中加入少量明礬,水解生成Al(OH)3膠體可以起到殺菌消毒的作用
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (g)$?_{高溫}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高溫}^{Pt-Sn/Al_{2}O_{3}}$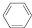 (g)+3H2(g).
(g)+3H2(g).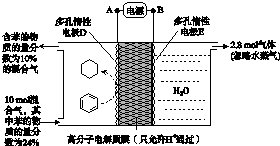
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
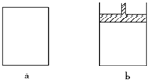 有a、b兩個極易導熱的密閉容器,a保持容積不變,b中的活塞可上下移動,以保持內外壓強相等.在相同條件下將3molA、1molB分別同時混合于a、b兩容器中,發生反應:
有a、b兩個極易導熱的密閉容器,a保持容積不變,b中的活塞可上下移動,以保持內外壓強相等.在相同條件下將3molA、1molB分別同時混合于a、b兩容器中,發生反應:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com