

分析 (1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根據蓋斯定律,②+③-①計算;
(2)根據元素守恒和電子得失守恒寫出化學方程式;
(3)該反應正向為體積增大的方向,壓強越大,CH4的轉化率越小;壓強為P2時,在Y點反應未達到平衡,則反應正向移動;X點CH4的平衡轉
化率為80%,根據化學平衡常數K=$\frac{c{\;}^{2}(CO)c{\;}^{2}(H{\;}_{2})}{c(CO{\;}_{2})c(CH{\;}_{4})}$結合三組量代入計算;
(4)①由圖可知,溫度超過275~300℃時,催化劑的催化效率降低,所以溫度升高而乙酸的生成速率降低;300~400℃時溫度升高,化學反應速率加快;
②提高該反應中CH4的轉化率,改變條件應使平衡向正反應方向移動,注意不能只增大甲烷的濃度,否則甲烷的轉化率降低;
③寫出醋酸電離平衡常數、醋酸根離子水解平衡常數,水的離子積常數進行比較,從而得出結論.
解答 解:(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根據蓋斯定律,②+③-①得:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-73-171+41=-203kJ•mol-1,
故答案為:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-203kJ•mol-1;
(2)一定條件下向NH4HS溶液中通入空氣,得到單質硫并再生出吸收液即氨水,則根據元素守恒及題中的反應物和生成物可知化學方程式為:2NH4HS+O2$\frac{\underline{\;一定條件下\;}}{\;}$2NH3•H2O+2S↓,故答案為:2NH4HS+O2$\frac{\underline{\;一定條件下\;}}{\;}$2NH3•H2O+2S↓;
(3)該反應正向為體積增大的方向,壓強越大,CH4的轉化率越小,已知相同溫度下,P1條件下的轉化率大于P2,則P1小于P2;壓強為P2時,在Y點反應未達到平衡,則反應正向移動,所以v(正)大于v(逆);
X點CH4的平衡轉化率為80%,
則 CO2(g)+CH4(g)?2CO(g)+2H2(g),
開始0.1 0.1 0 0
轉化0.08 0.08 0.16 0.16
平衡0.02 0.02 0.16 0.16
其平衡常數表達式是K=$\frac{c{\;}^{2}(CO)c{\;}^{2}(H{\;}_{2})}{c(CO{\;}_{2})c(CH{\;}_{4})}$=$\frac{0.16{\;}^{2}×0.16{\;}^{2}}{0.02×0.02}$,
故答案為:<;>;$\frac{0.16{\;}^{2}×0.16{\;}^{2}}{0.02×0.02}$;
(4)①溫度超過275~300℃時,催化劑的催化效率降低,所以溫度升高而乙酸的生成速率降低;300~400℃時溫度升高,化學反應速率加快;
,故答案為:275~300℃時催化劑的催化效率降低,化學反應速率降低,300~400℃時溫度升高,化學反應速率又加快;
②提高該反應中CH4的轉化率,改變條件應使平衡向正反應方向移動,正反應是氣體體積減小的反應,縮小容器體積增大壓強、增大CO2的濃度,平衡正向移動,反應物轉化率增大,故答案為:增大反應壓強或增大CO2的濃度;
③電離方程式為HAc?H++Ac-,電離常數用Ka=$\frac{c(Ac{\;}^{-})c(H{\;}^{+})}{c(HAc)}$,乙酸根的水解方程式為Ac-+H2O?OH-+HAc,水解常數用Kh=$\frac{c(HAc)c(OH{\;}^{-})}{c(Ac{\;}^{-})}$,Kw=c(H+).c(OH-),所以Ka•Kh=Kw,則
Kh=$\frac{K{\;}_{w}}{K{\;}_{a}}$,故答案為:$\frac{K{\;}_{w}}{K{\;}_{a}}$.
點評 本題考查了蓋斯定律的應用、方程式的書寫、化學平衡常數、平衡移動等,題目涉及的知識點較多,側重于考查學生對基礎知識的綜合應用能力,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
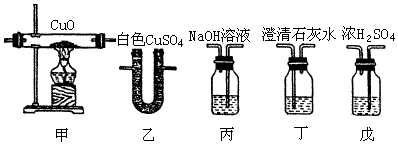
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 實驗步驟 | 預期現象和結論 |
| 步驟1:取C中的少量固體樣品于試管中,滴加足量蒸餾水至固體溶解,然后將所得溶液分別置于A、B試管中. | |
| 步驟2:向A試管中滴BaCl2溶液 | ①若無明顯現象,證明固體中不含碳酸鈉;②若溶液變渾濁,證明固體中含有碳酸鈉. |
| 步驟3:向B試管中滴加AgNO3溶液和稀硝酸 | 若溶液變渾濁,結合步驟2中的①,則假設一成立;結合步驟2中的②,則假設二成立. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
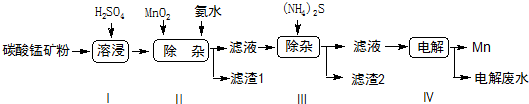
| 物質 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某課外小組設計的實驗室制取乙酸乙酯的裝置如圖所示,A中放有濃硫酸,B中放有乙醇、無水醋酸鈉,D中放有飽和碳酸鈉溶液.
某課外小組設計的實驗室制取乙酸乙酯的裝置如圖所示,A中放有濃硫酸,B中放有乙醇、無水醋酸鈉,D中放有飽和碳酸鈉溶液.| 試劑 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸點(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com