
| 實驗步驟 | 有關問題 |
| (1)計算所需濃硫酸的體積 | 需取濃硫酸(1.7)mL |
| (2)量 取濃硫酸 | 需要用到的主要儀器是:5mL量筒 |
| (3)將 濃硫酸沿著玻璃棒緩緩注入盛有水的燒杯中并攪拌 | 該操作要做到膽大心細,杜絕事故發生 |
| (4)待溶液冷卻至室溫,將燒杯中溶液轉移至250mL容量瓶中 | 要注意把洗滌液一并轉移至容量瓶中 |
| (5)向容量瓶中加蒸餾水至刻度線 | 在進行此操作時當加水至刻度線1-2cm處后的正確操作是:改用膠頭滴管逐滴滴加到凹液面最低處與刻度線相切 |
分析 依據配制溶液體積選擇合適的容量瓶,依據溶液稀釋過程中溶質的物質的量不變計算需要濃硫酸體積;量取濃硫酸用到的主要儀器為量筒,依據濃硫酸體積選擇合適規格的量筒;
注意濃硫酸稀釋的正確操作;注意定容的正確操作;
(1)依據配制一定物質的量濃度溶液操作步驟選擇需要儀器,判斷用不到的儀器;
(2)分析操作對溶質的物質的量和溶液體積的影響,依據C=$\frac{n}{V}$進行誤差分析;
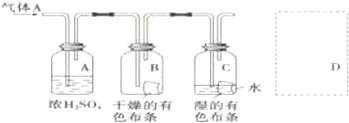
(3)混有氯化氫、水中氣的氯氣,通過濃硫酸進行干燥除去水蒸氣,進入B、C中,依據BC中布條顏色的變化得出結論:氯氣不具有漂白性,具有漂白性的是次氯酸,注意氯氣有毒需要進行尾氣處理,氯氣能夠與堿反應,可以用盛有氫氧化鈉的燒杯吸收過量的氯氣.
解答 解:配250mL0.1mol•L-1H2SO4溶液,應選擇250mL容量瓶,設需要15mol•L-1濃硫酸體積為V,則依據溶液稀釋過程中溶質的物質的量不變得:V×15mol/L=250mL×0.1mol/L,解得V=1.7mL;需要用到的主要儀器為5mL量筒;濃硫酸稀釋的正確操作:將濃硫酸沿著玻璃棒緩緩注入盛有水的燒杯中并攪拌;
定容的正確操作為:向容量瓶中加水至刻度線1-2cm處后改用膠頭滴管逐滴滴加到凹液面最低處與刻度線相切;
故答案為:
| 實驗步驟 | 有關問題 |
| (1)計算所需濃硫酸的體積 | 需取濃硫酸( 1.7)mL |
| (2)量 取濃硫酸 | 需要用到的主要儀器是:5mL量筒 |
| (3)將 濃硫酸 沿著玻璃棒緩緩注入盛有水的燒杯中并攪拌 | 該操作要做到膽大心細,杜絕事故發生 |
| (4)待溶液冷卻至室溫,將燒杯中溶液轉移至 250mL容量瓶中 | 要注意把洗滌液一并轉移至容量瓶中 |
| (5)向容量瓶中加蒸餾水至刻度線 | 在進行此操作時當加水至刻度線1-2cm處后的正確操作是:改用膠頭滴管逐滴滴加到凹液面最低處與刻度線相切 |
 ;
; ;
;點評 本題考查了一定物質的量濃度溶液的配制,氯氣干燥性探究實驗,明確配制原理和步驟是解題關鍵,注意探究實驗設計的嚴密性,題目難度不大.


 新活力總動員暑系列答案
新活力總動員暑系列答案 龍人圖書快樂假期暑假作業鄭州大學出版社系列答案
龍人圖書快樂假期暑假作業鄭州大學出版社系列答案科目:高中化學 來源: 題型:選擇題
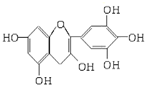 茶是我國的傳統飲品,茶葉中含有的茶多酚可以替代食品添加劑中對人體有害的合成抗氧化劑,用于多種食品保鮮等,如圖所示是茶多酚中含量最高的一種兒茶素A的結構簡式,關于這種兒茶素A的有關敘述正確的是( )
茶是我國的傳統飲品,茶葉中含有的茶多酚可以替代食品添加劑中對人體有害的合成抗氧化劑,用于多種食品保鮮等,如圖所示是茶多酚中含量最高的一種兒茶素A的結構簡式,關于這種兒茶素A的有關敘述正確的是( )| A. | ②④ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所有需要加熱的反應都是吸熱反應 | |
| B. | 所有金屬元素形成的化合物都是離子化合物 | |
| C. | 所有主族元素的族序數等于其原子最外層上的電子數 | |
| D. | 所有共價化合物分子中每個原子最外層都達到稀有氣體的穩定結構 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原電池將化學能轉變為電能 | |
| B. | 原電池將電能轉變為化學能 | |
| C. | 中和反應放熱說明中和反應前后能量不守恒 | |
| D. | 吸熱反應中生成物的總能量低于反應物的總能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 共價鍵 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1 ) | 436 | 157 | 568 | 432 | 298 |
| A. | 432 kJ•mol -1>E(H-Br)>298 kJ•mol -1 | |
| B. | 表中最穩定的共價鍵是H-F鍵 | |
| C. | H 2 (g)→2H (g)△H=+436 kJ•mol -1 | |
| D. | H 2 (g)+F 2 (g)=2HF(g)△H=-25 kJ•mol -1 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Ca2CO3+2HCl═CaCl2+H2O+CO2↑ | B. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | ||
| C. | Cu+4HNO3(稀)═Cu(NO3)2+2NO↑+2H2O | D. | NaCl+AgNO3═AgCl↓+NaNO3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com