
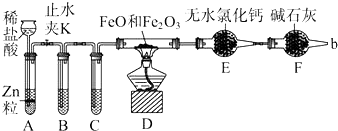
分析 A用于制備氫氣,氫氣中混有HCl、水,B用于除去氯化氫,C為干燥裝置,D中在加熱條件下生成鐵和水,E用于吸收水,根據水的質量和鐵的氧化物的質量列式可計算含量,F用于吸收空氣的水,防止影響實驗測定結構,導致實驗誤差,以此解答該題.
解答 解:(1)對A氣密性的檢查用液封法,即關閉止水夾K,從長頸漏斗向試管內加水,至長頸漏斗中管內的液面高于管外液面,靜置一段時間,若液面高度差不發生變化,則氣密性良好,
故答案為:關閉止水夾K,從長頸漏斗向試管內加水,至長頸漏斗中管內的液面高于管外液面,靜置一段時間,若液面高度差不發生變化,則氣密性良好;
(2)H2和O2混合點燃會爆炸,即可燃性氣體點燃前都必須檢驗純度,實驗開始后若未反應,H2排入空氣也會帶來危險,必須處理掉,
故答案為:檢驗氫氣的純度;點燃未反應的氫氣;
(3)A中產生的H2中混有HCl和水蒸氣,必須通過洗氣逐一除去,防止干擾后續實驗,所以裝置B的作用是除去氫氣中混有的氯化氫氣體,C為干燥裝置,可用濃硫酸干燥,故答案為:除去氫氣中混有的氯化氫氣體;濃硫酸;
(4)干燥管F的作用防空氣中水蒸氣對實驗干擾,若無干燥管F,空氣中的水蒸氣被E吸收則所測生成水的質量增大,即氧的含量增大,則FeO與Fe2O3相比較得Fe2O3的質量將偏大,
故答案為:防止空氣中的水蒸氣進入干燥管E中;偏大;
(5)設FeO、Fe2O3物質的量分別為x、y,則$\left\{\begin{array}{l}{72x+160y=ag}\\{18(x+3y)=bg}\end{array}\right.$,解得y=$\frac{4b-a}{56}$mol,則Fe2O3的質量為:$\frac{4b-a}{56}$mol×160 g•mol-1=$\frac{80b-20a}{7}$g,質量分數為$\frac{80b-20a}{7a}×100%$,
故答案為:$\frac{80b-20a}{7a}×100%$.
點評 本題考查了物質性質探究實驗的分析判斷,裝置基本操作的應用,為高考常見題型和高頻考點,側重于學生的分析能力、計算能力和實驗能力的考查,注意把握物質性質和實驗過程,題目難度中等.


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案 名題訓練系列答案
名題訓練系列答案 期末集結號系列答案
期末集結號系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.20 | B. | 0.25 | C. | 0.30 | D. | 0.35 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室是用乙醇在濃硫酸和170℃條件下制取乙烯的.
實驗室是用乙醇在濃硫酸和170℃條件下制取乙烯的.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 項目 | 氨堿法 | 聯合制堿法 |
| A. | 原料 | 食鹽、氨氣、生石灰 | 食鹽、氨氣、二氧化碳 |
| B. | 可能的副產物 | 氯化鈣 | 氯化銨 |
| C. | 循環物質 | 氨氣、二氧化碳 | 氨氣、氯化鈉 |
| D. | 評價 | 原料易得、產率高 | 設備簡單、能耗低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
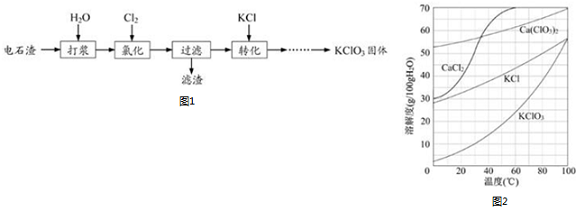
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
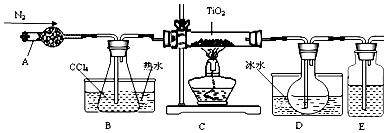
| 物質 | 熔點/℃ | 沸點/℃ | 其他 |
| CCl4 | -23 | 76 | 與TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮濕空氣產生白霧 |
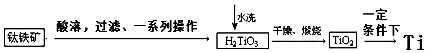
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com