
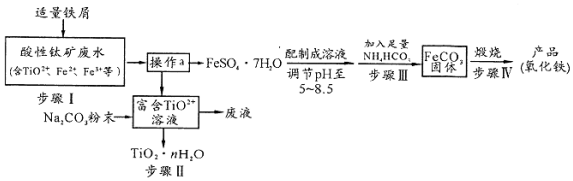
分析 鈦礦工業中的酸性廢水富含Ti、Fe等元素,含有TiO2+、Fe2+、Fe3+等離子,加入鐵粉還原鐵離子得到亞鐵離子,通過蒸發濃縮、冷卻結晶過濾洗滌、干燥得到硫酸亞鐵晶體,配制成溶液調節溶液PH5-5.8范圍內,加入足量碳酸氫銨,過濾得到碳酸亞鐵沉淀,在坩堝中灼燒得到氧化鐵,過濾后得到富含的TiO2+溶液,加入Na2CO3粉末與H+反應,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移動,可得到TiO2粗產品,以此解答該題.
(1)離子中個元素化合價代數和等于離子所帶電荷數計算,元素為-2價;
(2)步驟I中檢驗鈦礦廢水中加入鐵屑是否足量的試劑是檢驗是否含鐵離子;
(3)溶液中得到溶質固體的方法是蒸發濃縮、冷卻結晶過濾洗滌、干燥;
(4)步驟Ⅲ中發生反應是硫酸亞鐵和碳酸氫銨反應生成碳酸亞鐵沉淀、硫酸銨、二氧化碳和水,反應溫度一般需控制在35℃以下,是為了避免溫度過高碳酸氫銨分解,減少鐵離子的水解程度;
(5)根據溶液中c(Fe2+)•c(OH-)2與Ksp[Fe(OH)2]比較,可判斷有無Fe(OH)2沉淀,保證二價鐵被氧化為三價需要多通入空氣或氧氣;
(6)富含的TiO2+溶液,加入Na2CO3粉末與H+反應,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移動
解答 解:(1)離子中個元素化合價代數和等于離子所帶電荷數計算,元素為-2價,則TiO2+鈦的化合價為+4價,
故答案為:+4;
(2)步驟I中檢驗鈦礦廢水中加入鐵屑是否足量的試劑是檢驗是否含鐵離子,可以選擇加入KSCN溶液,溶液變紅色證明鐵加入不足,如溶液不變紅色證明鐵粉加入足量,
故答案為:KSCN溶液;
(3)操作a是溶液中得到溶質固體,方法是蒸發濃縮、冷卻結晶過濾洗滌、干燥,
故答案為:過濾洗滌、干燥;
(4)步驟Ⅲ中發生反應是硫酸亞鐵和碳酸氫銨反應生成碳酸亞鐵沉淀、硫酸銨、二氧化碳和水,反應的化學方程式為:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑,反應溫度一般需控制在35℃以下,是為了避免溫度過高碳酸氫銨分解,減少鐵離子的水解程度,
故答案為:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑;避免溫度過高碳酸氫銨分解,減少鐵離子的水解程度;
(5)室溫下測得溶液的pH為8.5,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8.5}}$=1×10-5.5,由題中數據可知,溶液中c(Fe2+)•c(OH-)2=1×10-6×(1×10-5.5)2=1×10-17<Ksp[Fe(OH)2]=8×10-16,故無Fe(OH)2沉淀生成,
故答案為:沒有;向容器中補充適量的空氣;
(6)富含的TiO2+溶液,加入Na2CO3粉末與H+反應,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移動,可得到TiO2粗產品,
故答案為:溶液中存在水解平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+,加入的Na2CO3粉末與H+反應,降低了溶液中c(H+),促進水解平衡向生成TiO2•n H2O的方向移動;
點評 本題考查物質的制備、為高考常見題型,側重于學生的分析能力、實驗能力的考查,注意把握實驗的原理和目的,為解答該類題目的關鍵,注意物質的性質,結合題給信息解答,難度中等.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:選擇題
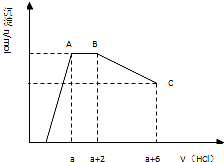 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等離子,當向溶液中逐滴加入鹽酸時,生成沉淀物質的量與加入鹽酸體積的關系如圖所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列結論不正確的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等離子,當向溶液中逐滴加入鹽酸時,生成沉淀物質的量與加入鹽酸體積的關系如圖所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列結論不正確的是( )| A. | 溶液中一定不存在的離子:Fe3+,Mg2+,Al3+ | |
| B. | AB段可得到能使澄清的石灰水變渾濁的氣體 | |
| C. | c(CO32-):c(AlO2-)=2:3 | |
| D. | BC段發生反應的離子方程式為Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol | B. | 0.2mol | C. | 0.4mol | D. | 0.6mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3:4:1 | B. | 3:1:2 | C. | 7:2:1 | D. | 9:3:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向Na2CO3溶液中通入CO2至溶液為中性,則$\frac{c({{N}_{a}}^{+})}{2c(C{{O}_{3}}^{2-})}$>1 | |
| B. | pH相同的氨水和Ba(OH)2溶液中2c(NH4+)=c(Ba2+) | |
| C. | 將CH3COONa溶液從25℃升溫至40℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| D. | 向Mg(OH)2濁液中加入少量NH4Cl粉末,$\frac{c(M{g}^{2+})}{c(O{H}^{-})}$不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 再通入少量氯氣,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$減小 | |
| B. | 通入少量SO2,溶液漂白性增強 | |
| C. | 加入少量的碳酸鈉粉末,pH增大,溶液漂白性增強 | |
| D. | 光照過程中,有氣泡冒出,溶液的導電性減弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯原子的電子排布式3s23p5 | B. | Cl-的結構示意圖  | ||
| C. | 氯離子的電子式Cl- | D. | 質量數為37的氯原子${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗目的 | 實驗方案 |
| A | 檢驗CH3CH2Br在NaOH溶液中是否發生水解 | 將CH3CH2Br與NaOH溶液共熱.冷卻后,取出上層水溶液,用稀HNO3酸化,加入AgNO3溶液,觀察是否產生淡黃色沉淀 |
| B | 檢驗Fe(NO3)2晶體是否已氧化變質 | 將Fe(NO3)2樣品溶于稀H2SO4后,滴加KSCN溶液,觀察溶液是否變紅 |
| C | 驗證Br2的氧化性強于I2 | 將少量溴水加入KI溶液中,再加入CCl4,振蕩,靜置,可觀察到下層液體呈紫色 |
| D | 驗證AgI的溶解度小于AgCl | 將NaI濃溶液加入AgCl懸濁液中,振蕩,可觀察到沉淀由白色變為黃色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com