
NH3及其鹽都是重要的化工原料。
(1)合成氨工業對化學的國防工業具有重要意義,寫出氨的兩種重要用途 。
(2)用NH4Cl和Ca(OH)2制備NH3,反應發生、氣體收集和尾氣處理裝置依次為 。
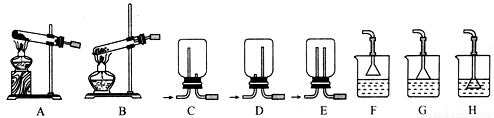
實驗室制備氨氣,下列方法中適宜選用的是 。
①固態氯化銨加熱分解 ②固體氫氧化鈉中滴加濃氨水
③氯化銨溶液與氫氧化鈉溶液共熱 ④加熱農氨水
(3)按下圖裝置進行NH3性質實驗。(已知AB兩瓶容積相同)
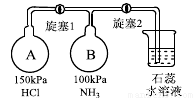
①先打開旋塞1,B瓶中的現象是 ,原因是 ,穩定后,關閉旋塞1。
②再打開旋塞2,B瓶中的現象是 。
(4)某興趣小組在實驗室探究工業合成硝酸的化學原理。
①氨的催化氧化:圖a是探究氨的催化氧化的簡易裝置,實驗中觀察到錐形瓶中鉑絲保持紅熱,有紅棕色氣體生成或白煙產生。白煙的成分是 (填化學式)。
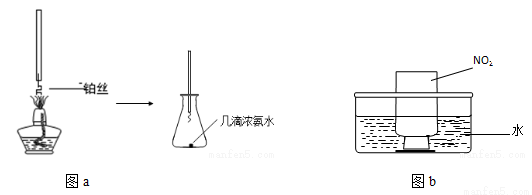
②NO2的吸收:如圖b所示,將一瓶NO2倒置于水槽中,在水下移開玻璃片,可觀察到的現象是 。
科目:高中化學 來源:2016屆江西南昌二中、臨川一中等高三4月聯考二理綜化學試卷(解析版) 題型:選擇題
有機物X、Y、M(已知M為乙酸)的轉化關系為:淀粉→X→Y 乙酸乙酯,下列說法不正確的是
乙酸乙酯,下列說法不正確的是
A.X可用新制的氫氧化銅懸濁液檢驗
B.實驗室由Y和M制取乙酸乙酯時可用飽和Na2CO3溶液來提純
C.乙酸乙酯的同分異構體中含有“-COO-”結構的還有3種
D.Y分子中含有3種不同環境的氫,峰面積比為3:2:1
查看答案和解析>>
科目:高中化學 來源:2016屆海南海南中學高三考前模擬十一化學試卷(解析版) 題型:填空題
消除氮氧化物和硫氧化物有助于預防霧霾天氣的形成。
(1)某恒容密閉容器中存在如下反應:C(s)+2NO(g)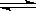 N2(g)+CO2(g)△H。維持溫度不變,測得不同時刻幾種氣體物質的濃度如下表所示:
N2(g)+CO2(g)△H。維持溫度不變,測得不同時刻幾種氣體物質的濃度如下表所示:
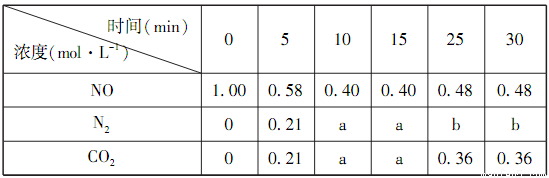
①0~10min內,NO的平均反應速率v(NO)=___________,該溫度下反應的平衡常數K=___________。
②表中25min的數據變化與反應進行到22min時改變了反應體系中的某一條件有關,則b=___________,改變的條件可能是___________。
A.加入一定量的活性炭
B.通入一定量的N2
C.適當縮小容器的體積
③若15min時升高溫度,達到平衡時容器中NO、N2、CO2的濃度之比為5:3:3,則△H___________0(填“>”、“=”或“<”)。
(2)NH3催化還原氮氧化物(產物是N2、H2O)是目前廣泛采用的煙氣脫氮技術
①當廢氣中NO2、NO的體積分數相等時脫氮率最高,若此情況下生成1molN2時反應放出的熱量為akJ,則對應的熱化學方程式為___________。
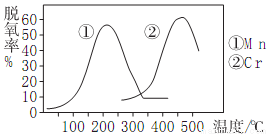
②右圖使用不同催化劑時的脫氮率,則脫氮時最佳的溫度、催化劑應是___________。
(3)用石灰漿作吸收劑也可脫去廢氣中的SO2,若處理結束時,測得吸收液中c(Ca2+)=0.70mol/L,則c(SO32-)=___________(已知Ksp(CaSO3)=1.4×10-7)。
查看答案和解析>>
科目:高中化學 來源:2016屆陜西省高三第五次適應性考試理綜化學試卷(解析版) 題型:實驗題
鈷(Co)及其化合物在工業上有廣泛應用。為從某工業廢料中回收鈷,某學生設計流程如下(廢料中含有Al、Li、Co2O3和Fe2O3等物質)。
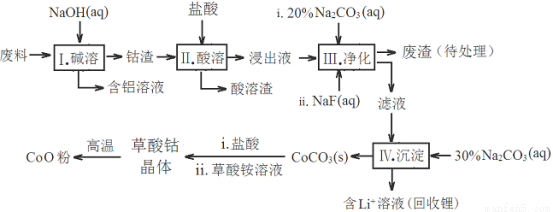
已知:①物質溶解性:LiF難溶于水,Li2CO3微溶于水;
②部分金屬離子形成氫氧化物沉淀的pH見下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(開始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
請回答:
(1)步驟Ⅰ中得到含鋁溶液的反應的離子方程式是____________________________。
(2)寫出步驟Ⅱ中Co2O3與鹽酸反應的離子方程式_________________________
(3)步驟Ⅲ中Na2CO3溶液的作用是調節溶液的pH,應使溶液的pH不超過__________。廢渣中的成分有______________________。
(4)NaF與溶液中的Li+形成LiF沉淀,此反應對步驟Ⅳ所起的作用是___________。
(5)在空氣中加熱CoC2O4固體,經測定,210~290℃的過程中只產生CO2和一種二化合物,該化合物中鈷元素的質量分數為73.44%。此過程發生反應的化學方程式是_________________。
(6)某鋰離子電池的總反應為C+LiCoO2 LixC+Li1-xCoO2,LixC中Li的化合價為______價,該鋰離子電池充電時陽極的電極反應式為______________。
LixC+Li1-xCoO2,LixC中Li的化合價為______價,該鋰離子電池充電時陽極的電極反應式為______________。
查看答案和解析>>
科目:高中化學 來源:2016屆陜西省高三第五次適應性考試理綜化學試卷(解析版) 題型:選擇題
設NA為阿伏伽德羅常數的值,下列說法正確的是
A.1mol二甲醚中含有的C—O鍵的數目為2NA
B.標準狀況下,44.8LHF中含有分子的數目為2NA
C.200g質量分數為23%的HCOOH水溶液中含氧原子的總數目為2NA
D.在反應Cu2S+O2 2Cu+SO2中,每生成1molCu,轉移電子的數目為2NA
2Cu+SO2中,每生成1molCu,轉移電子的數目為2NA
查看答案和解析>>
科目:高中化學 來源:2015-2016學年內蒙古包頭九中高一下第一次月考化學試卷(解析版) 題型:選擇題
標準狀況下,將aLH2和Cl2的混合氣體點燃,充分反應后,將混合氣體通入含b molNaOH的熱溶液中,氣體恰好被完全吸收,NaOH無剩余,測得反應后溶液中含Cl―、ClO―、ClO3―,且三者物質的量之比為8:1:1,則原混合氣體中H2的物質的量
A.a/2mol B.(a/22.4-b)mol C(a/22.4-b/2)mol D.b/2mol
查看答案和解析>>
科目:高中化學 來源:2015-2016學年內蒙古包頭九中高一下第一次月考化學試卷(解析版) 題型:選擇題
將X氣體通入BaCl2溶液,未見沉淀生成,然后通入Y氣體,有沉淀生成,X、Y不可能是
選項 | X | Y |
A | SO2 | H2S |
B | Cl2 | CO2 |
C | NH3 | CO2 |
D | SO2 | Cl2 |
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高一下期中化學試卷(解析版) 題型:選擇題
X、Y是元素周期表第VIIA族的兩種元素,下列說法中能說明X的非金屬性比Y強的是( )
A.X元素原子的電子層數比Y元素原子的電子層數多
B、X的氣態氫化物比Y的氣態氫化物穩定
C、X的最高價氧化物對應水化物的酸性比Y的弱
D、Y的單質能將X從NaX溶液中置換出來
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省高一下期中化學試卷(解析版) 題型:選擇題
短周期主族元素W、R、X、Y、Z,原子序數依次增大。W、X、Y三種元素原子的最外層電子數之和為15,Y原子核電荷數等于W原子核電荷數的2倍,R原子最外層電子數與X原子最外層電子數相差1。下列敘述正確的是
A、R在化合物中顯+1價
B、最高價氧化物的水化物的堿性:X>R
C、原子半徑:X>Y>Z
D、簡單氣態氫化物的沸點:Y>W
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com