
【題目】球墨鑄鐵中含有一種鐵碳化合物X。實驗室測定化合物X的組成實驗如下:

下列說法不正確的是
A.固體2是Fe2O3
B.溶液甲中可能含有Fe3+
C.X的化學式可以表示為Fe3C2
D.X與足量的熱濃硝酸反應有NO2和CO2生成
【答案】C
【解析】
鐵碳化合物X,在足量空氣中煅燒得固體1為鐵的氧化物,可以有+2價或+3價的鐵,溶于鹽酸所得溶液中可能Fe2+和Fe3+,再通入足量的氯氣,溶液中都為+3價的鐵,加熱蒸發,鐵離子水解,生成氫氧化鐵,灼燒后氫氧化鐵分解得固體2為氧化鐵,24g氧化鐵中含有鐵元素的質量為24g×![]() =16.8g,利用元素守恒,可計算得化合物X中鐵元素的質量也是16.8g,進而求得X中碳元素的質量為18g-16.8g=1.2g,所以在X中鐵、碳原子的物質的量之比為
=16.8g,利用元素守恒,可計算得化合物X中鐵元素的質量也是16.8g,進而求得X中碳元素的質量為18g-16.8g=1.2g,所以在X中鐵、碳原子的物質的量之比為![]() :
:![]() =3:1,所以X的化學式為Fe3C,Fe3C與熱的濃硝酸發生氧化還原反應,碳元素可被氧化成二氧化碳,硝酸中的氮可被還原成二氧化氮,根據上面的分析可知。
=3:1,所以X的化學式為Fe3C,Fe3C與熱的濃硝酸發生氧化還原反應,碳元素可被氧化成二氧化碳,硝酸中的氮可被還原成二氧化氮,根據上面的分析可知。
A、固體2是氧化鐵,故A正確;
B、溶液甲中可能含有Fe3+,故B正確;
C、X的化學式可以表示為Fe3C,故C錯誤;
D、X與足量的熱濃硝酸反應有NO2和CO2生成,故D正確;
故選C。


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:
【題目】解釋下列事實所用的方程式不合理的是
A.硫酸酸化的KI淀粉溶液久置后變藍:4I-+O2 +4H+=2I2+2H2O
B.NaHCO3溶液顯堿性:HCO3-+H2OCO32-+OH-
C.用Na2CO3溶液處理鍋爐水垢中的硫酸鈣:CO32- +CaSO4 =CaCO3 +SO42-
D.氨水顯堿性:NH3·H2ONH4++OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、Z、W的原子序數依次遞增,其中Y與Z同主族。X與Y、Z與W均可形成如圖所示的分子結構,且Z與W形成的分子中所有原子最外層均滿足8電子穩定結構。下列說法中正確的是

A.原子半徑:W > Z > Y > X
B.氣態氫化物熱穩定性:Y > Z > W
C.元素Z和W均存在兩種以上的含氧酸
D.元素Z和W在自然界中均只能以化合態存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組利用H2C2O4溶液和酸性KMnO4溶液反應來探究“外界條件對化學反應速率的影響”。實驗時,先分別量取兩種溶液,然后倒入試管中迅速振蕩混合均勻,開始計時,通過褪色所需時間來判斷反應的快慢。該小組設計了如下方案:
實驗編號 | H2C2O4溶液 | 酸性KMnO4 | 溫度 | ||
濃度(mol/L) | 體積(mL) | 濃度(mol/L) | 體積(mL) | ||
0.10 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 50 | |
(1)已知反應后H2C2O4轉化為CO2逸出,KMnO4轉化為MnSO4,為了觀察到紫色褪去,H2C2O4與KMnO4初始的物質的量需要滿足的關系為n(H2C2O4):n(KMnO4)≥__。
(2)試驗編號②和③探究的內容是____。
(3)實驗①測得KMnO4溶液的褪色時間為40s,忽略混合前后溶液體積的微小變化,這段時同內平均反應速率v(KMnO4)=___mol·L-1·min-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】非索非那定(化合物H)是一種重要的抗過敏藥,其部分合成路線如下:
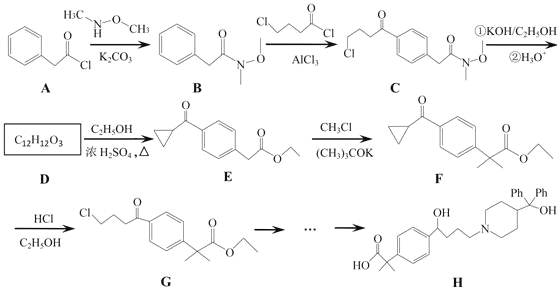
(1)B→C的反應類型為_______,E分子中含氧官能團有_______(寫名稱)。
(2)D的結構簡式為_________。
(3)F→G反應的化學方程式為__________。
(4)清寫出一種同時滿足下列條件的B的同分異構體的結構簡式:____________。
①苯環上有3個取代基;②具有a-氨基酸結構;③有6種不同化學環境的氫原子。
(5) 是一種重要的有機合成中間體,請完成乙苯乙烯為主要原料(其他試劑自選)合成該化合物的合成路線流程圖__________。合成路線流程圖示例如下
是一種重要的有機合成中間體,請完成乙苯乙烯為主要原料(其他試劑自選)合成該化合物的合成路線流程圖__________。合成路線流程圖示例如下![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】教材采用圖1實驗裝置測定鋅與稀硫酸反應的速率。

(1)檢查圖1裝置氣密性的操作方法是___。
(2)分別取2g顆粒大小相同的鋅粒分別與體積均為40mL的1mol/L硫酸、4mol/L硫酸反應,收集25mLH2時所需時間后者比前者___。
(3)同學們在實驗操作中發現本實驗設計存在明顯不足,例如___。
(4)某化學興趣小組對教材實驗裝置進行圖2所示改進。檢查裝置氣密性后進行的實驗操作有:
a.在多孔塑料袋中裝入鋅粒;
b.在錐形瓶中加入40mL1mol/L硫酸;
c.塞好橡膠塞,___時立即用秒表計時;
d.注射器內每增加5mL氣體時讀取一次秒表。
(5)實驗觀察到鋅與稀硫酸反應初期速率逐漸加快,其原因是___,反應進行一定時間后速率逐漸減慢,原因是___。
(6)測得產生H2的體積與反應時間的關系曲線如圖3所示,t1~t2時間段氫氣體積略有減小的原因是___;在64s內用H+濃度表示的平均反應速率v(H+)=___(此時,溶液體積仍為40mL,氣體摩爾體積為25L/mol)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兩種氣態烴以任意比例混合,在120℃,常壓下,取1L該混合烴在3.5L氧氣中完全燃燒,恢復到原狀態,測得氣體體積為4.5L,則符合該條件的烴的組合是
A.CH4、C3H6B.CH4、C2H4C.C2H4、C3H8D.C2H2、C3H6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.10mol/LNaOH溶液分別滴定20.00mL濃度均為0.10mol/LCH3COOH溶液和HCN溶液所得滴定曲線如圖[Ka(CH3COOH)>K(HCN)]。下列說法正確的是( )
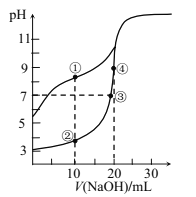
A.點①和點②所示溶液中:c(CH3COO-)<c(CN-)
B.點③所示溶液中:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.點①和點②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.點③和點④所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一體積為2L的密閉容器中充入2mol X,一定條件下可發生反應:2X(g)![]() 3Y(g),該反應的反應速率(v)與時間(t)的關系如圖所示,已知
3Y(g),該反應的反應速率(v)與時間(t)的關系如圖所示,已知![]() min時容器內有1.5mol Y。下列敘述正確的是( )
min時容器內有1.5mol Y。下列敘述正確的是( )

A. 若![]() min時升高溫度,則反應速率不變
min時升高溫度,則反應速率不變
B. ![]() ~
~![]() min內,
min內,![]() ,反應不再發生
,反應不再發生
C. 0~![]() min內,
min內,![]()
D. ![]() min時,只有正反應發生
min時,只有正反應發生
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com