

| A、甲為CO2;乙為NH3 |
| B、由濾液提純(NH4)2SO4過(guò)程中的實(shí)驗(yàn)操作為萃取 |
| C、CO2可被循環(huán)使用 |
| D、上述過(guò)程中涉及到的反應(yīng)全部是氧化還原反應(yīng) |
 Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移動(dòng),有利于(NH4)2SO4的生成,則甲為NH3,故A錯(cuò)誤;
Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移動(dòng),有利于(NH4)2SO4的生成,則甲為NH3,故A錯(cuò)誤; Ca(OH)2+(NH4)2SO4及碳酸鈣的生成和分解中均沒(méi)有元素的化合價(jià)變化,均為非氧化還原反應(yīng),故D錯(cuò)誤.
Ca(OH)2+(NH4)2SO4及碳酸鈣的生成和分解中均沒(méi)有元素的化合價(jià)變化,均為非氧化還原反應(yīng),故D錯(cuò)誤.


| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
| A、該反應(yīng)較高溫度下不容易自發(fā)進(jìn)行,在低溫下容易自發(fā)進(jìn)行 |
| B、增大壓強(qiáng),X、Y、Z濃度均增大,正、逆反應(yīng)速率均加快 |
| C、升高溫度,反應(yīng)活化能降低,反應(yīng)速率加快 |
| D、其他條件不變,增大反應(yīng)物濃度,平衡常數(shù)增大 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
A、反應(yīng)A+B
| ||||
| B、相同溫度下,與同濃度鹽酸反應(yīng)的鋅粉和鐵粉產(chǎn)生氫氣的速率 | ||||
| C、相同溫度下,顆粒大小相同的生鐵分別在水和飽和食鹽水中的腐蝕生銹 | ||||
| D、一定溫度下,相同氫離子濃度、相同體積的鹽酸與硫酸分別與大小相同的鋅片反應(yīng),產(chǎn)生氣泡的快慢 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
| 物質(zhì) | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸點(diǎn)(℃) | 56.2 | 77.06 | 78 | 117.9 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
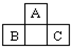 如圖為短周期一部分.A、C兩元素原子核外分別有兩個(gè)、一個(gè)未成對(duì)電子.試回答:
如圖為短周期一部分.A、C兩元素原子核外分別有兩個(gè)、一個(gè)未成對(duì)電子.試回答:查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
| A、Na+、Ba2+、Cl-、SO42- |
| B、K+、Na+、NO3-、OH- |
| C、H+、NH4+、Fe3+、SO42- |
| D、H+、Cl-、CH3COO-、NO3- |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:

| A、圖1配制250 mL 0.10 mol?L-1鹽酸 |
| B、圖2稀釋濃硫酸 |
| C、圖3稱(chēng)量氯化鈉固體 |
| D、圖4檢驗(yàn)鐵粉與水蒸氣反應(yīng)產(chǎn)生的氫氣 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
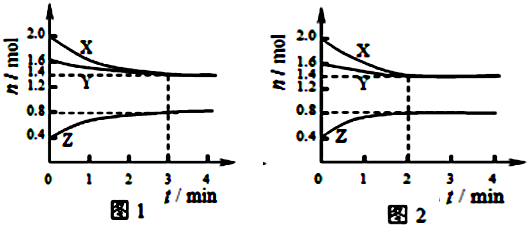
| A、容器中發(fā)生的反應(yīng)可表示為:3X(g)+Y(g)?2Z(g) |
| B、反應(yīng)進(jìn)行前3min內(nèi),用X表示的反應(yīng)速率v(X)=0.1mol/(L?min) |
| C、若改變反應(yīng)條件,使反應(yīng)進(jìn)程如圖2所示,則改變的條件是增大壓強(qiáng) |
| D、如圖1所示,該反應(yīng)達(dá)到化學(xué)平衡時(shí),X的轉(zhuǎn)化率為70% |
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com