
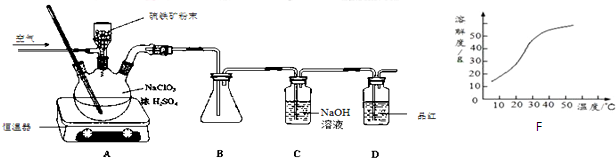
分析 (1)NaClO3與FeS2的反應中,氯從+5價變為+4價,鐵從+2價變為+3價,硫從-2價變為+6價,根據化合價升降法結合電荷守恒和元素守恒配平離子方程式;
(2)ClO2熔點為-59℃,沸點為11.0℃,B中要收集ClO2,要有冰水浴;
(3)ClO2有強氧化性,能使品紅褪色,通過品紅可以判斷ClO2是否吸收完全;
(4)從溶液中制取溶質,一般采用蒸發結晶、過濾、洗滌、干燥的方法;
(5)①滴定時用淀粉做指示劑,溶液開始是藍色,當滴定到終點時,溶液的藍色會褪色;
②根據關系式2ClO2~5I2~10Na2S2O3計算c(ClO2).
解答 解:(1)NaClO3與FeS2的反應中,氯從+5價變為+4價,鐵從+2價變為+3價,硫從-2價變為+6價,根據化合價升降法結合電荷守恒和元素守恒配平離子方程式為15ClO3-+FeS2+14H+=15ClO2+Fe3++2SO42-+7H2O,
故答案為:15;1;14;15;1;2;7;
(2)ClO2熔點為-59℃,沸點為11.0℃,B中要收集ClO2,要用冰水浴裝置,
故答案為:冰水浴;
(3)ClO2有強氧化性,能使品紅褪色,所以裝置D的現象是紅色褪去,
故答案為:紅色褪去;
(4)從溶液中制取溶質,一般采用蒸發結晶、過濾、洗滌、干燥的方法,防止析出晶體NaClO2•3H2O,趁熱過濾,
故答案為:蒸發結晶;趁熱過濾;
(5)①滴定時用淀粉做指示劑,溶液開始是藍色,當滴定到終點時,溶液的藍色會褪色,所以判斷滴定終點的現象是加到最后一滴時,溶液的顏色突然由藍色變為無色,且半分鐘不變化,
故答案為:加到最后一滴時,溶液的顏色突然由藍色變為無色,且半分鐘不變化;
②設原ClO2溶液的濃度為x,
2ClO2~5I2~10Na2S2O3
2mol 10mol
$\frac{10{\;}^{-2}x×V{\;}_{1}×10{\;}^{-3}}{10{\;}^{-1}}$ 1×10-3cV2mol
x=$\frac{2cV{\;}_{2}}{{V}_{1}}$mol/L,
故答案為:$\frac{2cV{\;}_{2}}{{V}_{1}}$.
點評 本題考查物質的制備、對信息的利用、對裝置的理解、氧化還原反應等,理解反應原理,掌握實驗基本操作是解題的關鍵,同時考查學生分析問題、解決問題的能力,難度較大,注意氧化還原反應的計算.


 出彩同步大試卷系列答案
出彩同步大試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 乙烯和苯都能與溴水反應 | |
| B. | 甲烷、乙烯和苯在工業上都可通過石油分餾得到 | |
| C. | 有機物分子中都存在碳碳單鍵 | |
| D. | 乙醇可以被氧化為乙酸,二者都能發生酯化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaClO溶液:ClO-+H2O═HClO+OH- | B. | FeCl3溶液:Fe3++3H2O?Fe(OH)3↓+3H+ | ||
| C. | Na2S溶液:S2-+H2O?H2S+2OH- | D. | NH4Cl溶液:NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
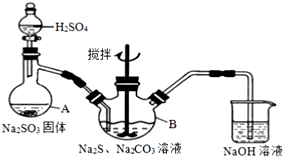 硫代硫酸鈉(Na2S2O3)是一種重要的化工產品.某興趣小組在查閱資料后制備Na2S2O3,結合其性質進行了實驗探究.
硫代硫酸鈉(Na2S2O3)是一種重要的化工產品.某興趣小組在查閱資料后制備Na2S2O3,結合其性質進行了實驗探究.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 氯氣溶于水:Cl2+H2O═H++Cl-+HClO | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | 酸性溶液中KIO3與KI反應生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 向Na2SiO3溶液中通入過量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 步驟 | 實驗操作 | 實驗現象及數據 |
| ① | 取wgM粉末溶于過量的鹽酸 | 產生氣體X在標準狀況下的體積為224mL,并得到無色溶液 |
| ② | 向步驟①所得的溶液中滴加氨水,調節pH至6,過濾、洗滌、灼燒、稱重 | 固體Y的質量為1.020g |
| ③ | 向步驟②所得的濾液中滴加氫氧化鈉溶液,調節pH至12,過濾、洗滌、灼燒、稱重 | 固體Z的質量為1.200g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaCl | B. | Na2O2 | C. | Na2SO4 | D. | SiO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
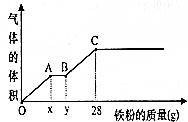 將400mL稀硫酸和稀硝酸的混合溶液平分成兩份.向其中一份中逐漸加入銅粉,最多能溶解19.2g銅,且反應后溶液中還有硫酸剩余;向另一份中逐漸加入鐵粉,產生氣體的體積和所加鐵粉質量的變化關系如圖所示.請回答下列問題(假設硝酸只被還原為NO氣體):
將400mL稀硫酸和稀硝酸的混合溶液平分成兩份.向其中一份中逐漸加入銅粉,最多能溶解19.2g銅,且反應后溶液中還有硫酸剩余;向另一份中逐漸加入鐵粉,產生氣體的體積和所加鐵粉質量的變化關系如圖所示.請回答下列問題(假設硝酸只被還原為NO氣體):查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com