

分析 (1)比較兩種元素的非金屬性強弱,可根據單質之間的置換反應、與氫氣反應的難易程度、氫化物的穩定性以及最高正價氧化物對應水化物酸性強弱,據此分析;
(2)KMnO4與濃鹽酸反應生成氯氣,氯氣具有強氧化性,能將碘離子氧化為碘單質,碘遇淀粉試液變藍色,由此分析解答;
(3)①根據圖2可知,D中Cl元素化合價為+7價,根據ClOX-中化合價代數和為-1判斷x值;
②B→A+C,根據轉移電子守恒得該反應方程式為3ClO-=ClO3-+2Cl-,反應熱=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,據此答題.
解答 解:(1)①Cl2、Br2、I2的顏色逐漸加深,是物理性質,無法比較非金屬性強弱,故①錯誤;
②Cl2、Br2、I2的氧化性逐漸減弱,說明非金屬性減弱,能夠據此判斷氯、溴、碘元素非金屬性強弱,故②正確;
③HCl、HBr、HI的酸性不是最高價含氧酸,無法據此判斷非金屬性強弱,故③錯誤; ④HCl、HBr、HI的熱穩定性逐漸減弱,說明非金屬性減弱,能夠據此判斷氯、溴、碘元素非金屬性強弱,故④正確;
⑤Cl2、Br2、I2和H2反應條件由光照(或點燃)→一定溫度→持續加熱,條件由易到難,說明非金屬性減弱,能夠據此判斷氯、溴、碘元素非金屬性強弱,故⑤正確;
⑥AgCl、AgBr、AgI的顏色逐漸加深,與非金屬性強弱無關,無法據此判斷氯、溴、碘元素非金屬性強弱,故⑥錯誤;
故答案為:②④⑤;
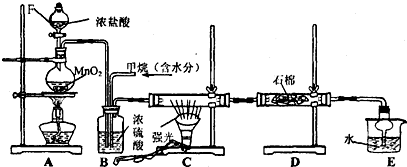
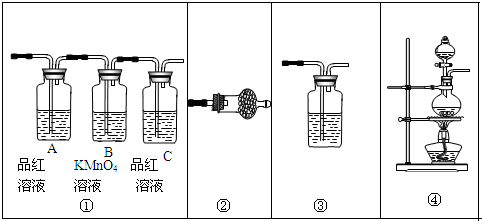
(2)KMnO4與濃鹽酸反應生成氯氣,氯氣與淀粉碘化鉀混合溶液反應生成碘單質,碘遇淀粉試液變藍色,故C中溶液變為藍色,氯氣與淀粉碘化鉀混合溶液反應離子方程式為:Cl2+2I-═2Cl-+I2,則證明了非金屬性:Cl>I,所以燒瓶A中應盛放的藥品是KMnO4;試管C中應盛放的藥品是粉碘化鉀溶液,則裝置D的作用是用氫氧化鈉吸收多余的氯氣,防止污染環境;當觀察到現象溶液變為藍色可證明非金屬性Cl>I,
故答案為:⑥;⑤;吸收未反應完的氯氣,防止污染環境;C中溶液變藍;
(3)①根據圖象知,D中Cl元素化合價為+7價,所以ClOx-中x為4,則D為ClO4-,
故答案為:ClO4-;
②B→A+C,根據轉移電子守恒得該反應方程式為3ClO-=ClO3-+2Cl-,反應熱=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以生成1molClO3-時,放出117kJ的熱,
故答案為:3ClO-=ClO3-+2Cl-;放出117.
點評 本題考查實驗方案設計,涉及非金屬性強弱的比較,反應熱的有關計算等知識,題目難度中等,明確物質的性質是解本題關鍵,試題有利于提高學生的分析能力及化學實驗能力.


科目:高中化學 來源: 題型:選擇題
| A. | BaSO4的水溶液導電性極弱:BaSO4?Ba2++SO42- | |
| B. | KHSO4在熔融狀態下可導電:KHSO4=K++H++SO42+ | |
| C. | 常溫下,0.1 mol/L的HF 溶液的pH>1:HF+H2O?H3O++F- | |
| D. | 向KI-淀粉溶液中滴加稀硫酸,溶液變藍色:4I-+O2+2H2O=2I2+4OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 阿司匹林(乙酰水楊酸,)是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128℃~135℃.某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,反應原理如下:
阿司匹林(乙酰水楊酸,)是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128℃~135℃.某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,反應原理如下:
| 名稱 | 相對分子質量 | 熔點或沸點(℃) | 水 |
| 水楊酸 | 138 | 158(熔點) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸點) | 易水解 |
| 乙酰水楊酸 | 180 | 135(熔點) | 微溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 坩堝質量(g) | 坩堝和晶體的總質量(g) | 加熱后坩堝和剩余固體的質量(g) |
| 11.685 | 13.691 | 12.948 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com