
| A. | 恒溫恒容,充入N02氣體,其轉化率增大 | |
| B. | 加壓,平衡向逆反應方向移動,混合氣體顏色變深 | |
| C. | 若平衡常數增大,則可能是升高了溫度或減小了體系的壓強 | |
| D. | 當2v正(NO)=v逆(O2)時,反應達到化學平衡狀態 |
分析 A、利用等效平衡分析,假設將充入的NO2氣體放在另一個容器中建立與原平衡為等效平衡的體系,再將該體系加入到原平衡體系中,容器體積不變是,相當于加壓,平衡逆向移動;
B、容器體積減小,平衡向體積減小的方向移動,混合氣體的顏色與NO2的濃度成比例,據此判斷;
C、根據影響平衡常數的因素判斷,平衡常數只隨溫度變化;
D、化學反應速率之比等于化學方程式計量數之比為正反應速率之比.
解答 解:A、假設將充入的NO2氣體放在另一個容器中建立與原平衡為等效平衡的體系,再將該體系加入到原平衡體系中,容器體積不變是,相當于加壓,平衡逆向移動,NO2氣體的轉化率減小,故A錯誤;
B、因為該反應是體積增大的反應,容器體積減小,平衡逆向移動,NO2的濃度增大,體積減小,所有物質的濃度也都會增大,所以混合氣體的顏色會加深,故B正確;
C、平衡常數只受溫度影響,與壓強無關,故C錯誤;
D、當v正(NO)═2v逆(O2),反應達到化學平衡,當2v正(NO)=v逆(O2)時不能說明反應達到平衡狀態,故D錯誤;
故選B.
點評 本題主要考查了影響化學平衡移動的因素、等效平衡的思想、影響平衡常數的因素及平衡狀態的判斷等知識點,中等難度,解題時注意化學原理知識的靈活運用.


科目:高中化學 來源:2016-2017學年江蘇省高一上10月階段測化學卷(解析版) 題型:實驗題
(1)欲驗證某溶液中含有較大量的Cl-、CO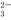 、S
、S O
O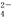 三種離子,如果只取一次該溶
三種離子,如果只取一次該溶 液,分別用三種試劑將三種離子檢驗出來(要求每一種試劑能檢驗出一種離子)。假設所加試劑均為足量,則加入試劑的先后順序為(寫化學式)____________、______________、____________。
液,分別用三種試劑將三種離子檢驗出來(要求每一種試劑能檢驗出一種離子)。假設所加試劑均為足量,則加入試劑的先后順序為(寫化學式)____________、______________、____________。
(2)溶液中存在Mg2+、Ag+、Ba2+三種金屬離子,現用NaOH、Na2CO3、NaCl三種溶液使它們分別沉淀并分離出來,要求每次只加一種溶液,濾出一種沉淀,所加溶液順序寫出對應的離子方程式_______________、_______________、________________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省高二上10月階段測化學卷(解析版) 題型:選擇題
下列有關物質用途的說法中,不正確的是
A.液氨常用作制冷劑 B.硅可用來制造半導體材料
C.CuO常用于制造紅色油漆 D.鋁合金可用于制造門窗
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
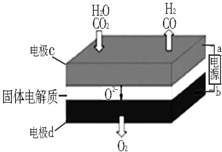 綜合利用CO2、CO對構建低碳社會有重要意義.
綜合利用CO2、CO對構建低碳社會有重要意義.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 及時除去二氧化碳,正反應速率加快 | |
| B. | 其它條件不變,加入催化劑,△H變大 | |
| C. | 增大壓強,正反應速率增大,逆反應速率減小 | |
| D. | 降低溫度,可提高反應物的轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解過程中陰極質量不變 | |
| B. | 電解過程中溶液的pH不斷升高 | |
| C. | 此時向溶液中加入適量的Ag2O固體可使溶液恢復電解前的狀況 | |
| D. | 電解后兩極產生的氣體體積比為2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol/L的NaOH溶液與0.2 mol/L的HCN溶液等體積混合,所得溶液呈堿性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| B. | 20 mL 0.1 mol/L的Na2CO3溶液與等體積等濃度的鹽酸混合充分反應后的溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2c(Cl-)=0.1 mol/L | |
| C. | 濃度均為1 mol/L的以下溶液:①醋酸 ②NaOH溶液 ③鹽酸 ④醋酸鈉溶液,其水的電離程度的關系為:④>①>③>② | |
| D. | 相同溫度下,pH值相同的CH3COONa溶液與NaHCO3溶液一定存在關系:c(CH3COO-)=c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
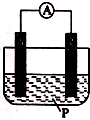 如圖所示裝置中,可觀察到電流表指針偏轉;M棒變粗,N棒變細,由此判斷下表所列M、N、P物質,其中可以成立的是 ( )
如圖所示裝置中,可觀察到電流表指針偏轉;M棒變粗,N棒變細,由此判斷下表所列M、N、P物質,其中可以成立的是 ( )| 選項 | M | N | P |
| A | 鋅 | 銅 | 稀硫酸溶液 |
| B | 銅 | 鋅 | 稀鹽酸 |
| C | 銀 | 鋅 | 硝酸銀溶液 |
| D | 鋅 | 鐵 | 硝酸鐵溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com