
【題目】下列有關溶液中微粒的物質的量濃度關系正確的是( )
A. 某弱酸的酸式鹽NaHA溶液中一定有:c(OH﹣)+2c(A2﹣)=c(H+)+c(H2A)
B. 0.2 molL﹣1 CH3COONa溶液與0.1 molL﹣1鹽酸等體積混合后的酸性溶液中:c(CH3COO﹣)>c(CH3COOH)>c(Cl﹣)>c(H+)
C. 室溫下,向100ml0.5mol/L的Na2CO3溶液中加入0.05molCaO,  溶液中增大
溶液中增大
D. 0.1 molL﹣1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3H2O)+c(Fe2+)=0.3 molL﹣1
【答案】C
【解析】A. 任何電解質溶液中都存在電荷守恒和物料守恒,根據電荷守恒得c(Na+)+c(H+)=c(OH)+c(HA)+2c(A2),根據物料守恒得c(HA)+c(A2)+c(H2A)=c(Na+),聯立兩式得c(OH)+c(A2)=c(H2A)+c(H+),故A錯誤;B. 0.2 molL﹣1 CH3COONa溶液與0.1 molL﹣1鹽酸等體積混合,得到等濃度的醋酸鈉、氯化鈉和醋酸的混合溶液,溶液顯酸性,說明醋酸的電離程度大于醋酸根離子的水解程度, 則c(CH3COOH)<c(Cl),故B錯誤;C. 氧化鈣和水反應生成氫氧化鈣,氫氧化鈣和碳酸鈉反應:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,溶液中氫氧根濃度增大,消耗碳酸根離子,則溶液中碳酸氫根離子濃度減小,溶液中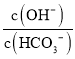 增大,故C正確;D. 0.1 molL﹣1 (NH4)2Fe(SO4)2溶液中存在物料守恒:c(NH4+)+c(NH3H2O)+c(Fe2+)+c[Fe(OH)2]=0.3 molL1,故D錯誤;答案選C。
增大,故C正確;D. 0.1 molL﹣1 (NH4)2Fe(SO4)2溶液中存在物料守恒:c(NH4+)+c(NH3H2O)+c(Fe2+)+c[Fe(OH)2]=0.3 molL1,故D錯誤;答案選C。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】Ⅰ.尿素[CO(NH2)2]是一種非常重要的高效氮肥,工業上以NH3、CO2為原料生產尿素,該反應實際為兩步反應:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)寫出工業上以NH3、CO2為原料合成尿素的熱化學方程式:_________________________
(2)某實驗小組模擬工業上合成尿素的條件,在一體積為0.5 L密閉容器中投入4 mol氨和1mol二氧化碳,實驗測得反應中各組分的物質的量隨時間的變化如下圖所示:
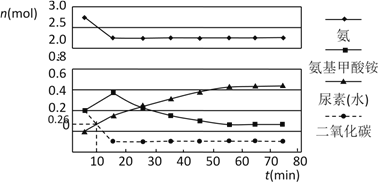
已知總反應的快慢由慢的一步決定,則合成尿素總反應的快慢由第_________步反應決定,總反應進行到_________min時到達平衡。
(3)電解尿素[CO(NH2)2]的堿性溶液制純凈氫氣的過程中同時產生氮氣。電解時,陽極的電極反應式為________________________________。
Ⅱ.用焦炭還原NO2的反應為:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒溫條件下,1 mol NO2和足量C發生該反應,測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示:
N2(g)+2CO2(g),在恒溫條件下,1 mol NO2和足量C發生該反應,測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示:
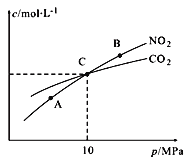
①A、B兩點的濃度平衡常數關系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②計算C點時該反應的壓強平衡常數Kp(C)=______(Kp是用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關金屬鈉的說法中,不正確的是
A.鈉應保存在煤油中
B.鈉在氧氣中燃燒生成淡黃色的Na2O2
C.鈉可以從硫酸銅溶液中還原出銅單質
D.鈉元素在自然界中都是以化合態存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】取碘水四份于試管中,編號為Ⅰ、Ⅱ、Ⅲ、Ⅳ,分別加入苯、CCl4、酒精、NaCl溶液,振蕩后靜置,現象正確的是( )
A.Ⅰ中溶液分層,下層呈紫紅色B.Ⅱ中溶液分層,下層呈紫紅色
C.Ⅲ中溶液分層,下層呈棕黃色D.Ⅳ中溶液分層
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用鋅冶煉廢渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制備ZnSO4和Fe2O3的實驗流程如下:

已知:“堿浸”時,NaOH溶液濃度越大越粘稠,越容易生成鋁硅酸鈉沉淀。
(1) “水浸”階段需在70~80℃條件下進行,適宜的加熱方式為________________。
(2)“氧化”階段是將Fe2+氧化后進一步生成Fe(OH)3,從反應產物的角度分析,以氯水替代H2O2的缺點是①使ZnSO4中混有ZnCl2;②________________。
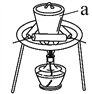
(3)“灼燒”時FeS2發生反應的化學方程式為________________。使用的裝置如右圖,儀器a的名稱為________________。
(4) “堿浸”階段,在其它條件不變的情況下,所得固體中Fe2O3含量隨NaOH溶液的濃度的增大而增大,但當氫氧化鈉濃度大于12 mol·L-1時,Fe2O3含量反而降低,其原因是________________。
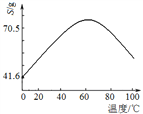
(5)“濾液Ⅰ”溶質主要是ZnSO4和CuSO4。已知硫酸鋅晶體的溶解度隨溫度變化如右圖,請設計從“濾液Ⅰ”中獲取ZnSO4晶體的實驗方案:________________(實驗中須使用的試劑有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮元素的單質和常見的化合物在工、農業生產中用途廣泛。
(1)常用作食品袋中填充氣的是_____,常用作制冷劑的化合物是_____,該物質在空氣中與HCl相遇有白煙現象,產生該現象的化學反應方程式是_______。
(2)銨鹽大多在農業上用作化肥。實驗室可用固體NH4Cl與固體Ca(OH)2加熱反應來制備氨氣,其化學方程式為_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com