
【題目】催化還原CO2是解決溫室效應及能源問題的重要手段之一。研究表明,在Cu/ZnO催化劑存在下,CO2和H2可發生兩個平行反應,分別生成CH3OH和CO。反應的熱化學方程式如下:
I.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
I.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
某實驗室控制CO2和H2初始投料比為1:2.2,在相同壓強下,經過相同反應時間測得如下實驗數據:
T(K) | 催化劑 | CO2轉化率(%) | 甲醇選擇性(%) |
543 | Cat.l | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.l | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[備注]XCat.1:Cu/ZnO納米棒;Cat.2:Cu/ZnO納米片;甲醇選擇性:轉化的CO2中生成甲醇的百分比。
已知:①CO和H2的標準燃燒熱分別為-283.0kJ/mol和一285.8kJ/mol;
②H2O(l)==H2O(g) △H3=+44.0kJ·mol-1
請回答下列問題(不考慮溫度對△H的影響):
(1)反應I在_________(填“低溫”或“高溫”)下自發進行;反應II每生成9g水蒸氣放出熱量為___________。
(2)恒容條件下,有利于提高CO2轉化為CH3OH的平衡轉化率的措施有_____(填字母代號)。
A.延長反應時間 B.使用催化劑Cat.2 C.降低反應溫度
D.投料比不變,增加反應物的濃度 E.增大CO2和H2的初始投料比
(3)由表中實驗數據可以得出的結論是_______________________。
(4)553K,使用催化劑Cat.2,在該時刻H2的轉化率為______(填字母代號)。
A.5.5% B.13.3% C.16.4% D.29.3%
(5)在下圖中分別畫出反應I在無催化劑、有Cat.1和有Cat.2三種情況下“反應過程~能量”示意圖。________
(6)研究證實,CO2也可在硫酸溶液中用情性電解生成甲醇,則生成甲醇的電極反應式是_________,另一極的電解產物為______________________。
【答案】 低溫 20.6kJ CD 在相同溫度下不同的催化劑對CO2 轉化成CH3OH的選擇性有顯著的影響(或在相同溫度下不同的催化劑對反應I的催化能力不同) C 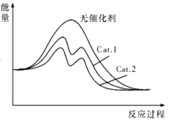 CO2+6H++6e-==CH3OH+H2O O2(H2SO4)
CO2+6H++6e-==CH3OH+H2O O2(H2SO4)
【解析】(1)反應I為I.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1 為放熱反應,
CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1 為放熱反應,
在低溫下自發進行;反應為II.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
已知CO和H2的燃燒熱分別為-283.0kJ·mol-1和-285.8kJ·mol-1,則①:CO(g)+![]() O2(g)=CO2(g)△H= -283.0kJ·mol-1②:H2(g)+
O2(g)=CO2(g)△H= -283.0kJ·mol-1②:H2(g)+![]() O2(g)=H2O (l)△H=-285.8kJ·mol-1③:H2O(l)=H2O(g)ΔH3=+44.0kJ·mol-1
O2(g)=H2O (l)△H=-285.8kJ·mol-1③:H2O(l)=H2O(g)ΔH3=+44.0kJ·mol-1
根據蓋斯定律分析,②-①+③即可得熱化學方程式為:
CO2(g)+ H2(g)![]() CO(g)+H2O(g)ΔH2=-285.8+283.0+44=+41.2 kJ·mo
CO(g)+H2O(g)ΔH2=-285.8+283.0+44=+41.2 kJ·mo
每生成9g水蒸氣放出熱量為20.6 kJ。
(2)反應Ⅰ中A、延長反應時間,平衡不移動,不能提高轉化率,A錯誤;B、使用催化劑,平衡不移動,不能提高轉化率,B錯誤;C、降低反應溫度,平衡正向移動,提高二氧化碳的轉化率,C正確;D、投料比不變,增加反應的濃度,平衡正向移動,提高二氧化碳的轉化率,D正確;E、增大二氧化碳和氫氣的初始投料比,能提高氫氣的轉化率,二氧化碳的會降低,E錯誤;;答案選CD。
(3)從表格數據分析,在相同的溫度下,不同的催化劑,其二氧化碳的轉化率也不同,說明不同的催化劑的催化能力不同;相同催化劑不同的溫度,二氧化碳的轉化率不同,且溫度高的轉化率大,因為正反應為放熱反應,說明表中數據是未到平衡數據。所以在相同溫度下不同的催化劑對CO2轉化成CH3OH的選擇性有顯著的影響。
(4)由.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1= -53.7kJ·mol-1
CH3OH(g)+H2O(g) △H1= -53.7kJ·mol-1
初始量 1 2.2 0 0
變化量0,12 0.36 0.12 0.12
平衡量 0,88 1.84 0.12 0.12
553K,使用催化劑Cat.2,在該時刻H2的轉化率為=0.36/2.2![]() =16.4
=16.4![]()
(5已知反應I在無催化劑、有Cat.1和有Cat.2三種情況下“反應過程~能量”示意圖。_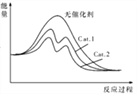
(6)CO2也可在酸性水溶液中通過電解生成甲醇C元素化合價降低,被還原,應為電解池的陰極反應,電極方程式為CO2+6H++6e- = CH3OH+H2O,陽極的4OH—4e-=O2![]() +H2O
+H2O
故答案為:CO2+6H++6e- = CH3OH+H2O,O2 (H2SO4)
點睛:掌握蓋斯定律是分析和計算反應熱常用的工具。根據方程式的加減確定反應熱的加減。同時注意反應熱的正負號。掌握平衡移動原理,注意只有濃度、溫度和壓強硬性平衡,注意催化劑的使用只能改變反應速率但不影響平衡,可以影響到達平衡的時間。當增大一種反應物的濃度時,平衡正向移動,另一種反應物的轉化率會提高,但本身轉化率會降低。本題考查了平衡常數和蓋斯定律,平衡移動的影響因素,和催化劑對反應的影響,綜合能力較強,題目難度中等。


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案 應用題作業本系列答案
應用題作業本系列答案科目:高中化學 來源: 題型:
【題目】在一定條件下,NO跟NH3可以發生反應:6NO+4NH3=5N2+6H2O,該反應中被氧化和被還原的氮元素的質量比是( )
A.3:2
B.2:1
C.1:1
D.2:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應屬于不屬于取代反應的是( )
A.油脂的水解
B.在一定條件下,苯與濃硝酸反應制取硝基苯
C.乙醛與氫氣的反應
D.甲烷與氯氣在光照條件下反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】僅根據題中圖示得出的結論不合理的是( )
A | B | C | D | |
圖示 |
|
|
|
|
結論 | HB為弱酸 | HF為弱電解質 | 溶解度:AgI<AgCl | 正反應△H>0 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2RO3是一種二元酸,常溫下,用1Llmol/LNa2RO3溶液吸收RO2氣體,溶液的pH隨RO2氣體的物質的量的變化如圖所示。下列說法不正確的是
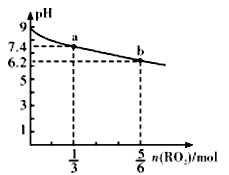
A. a點溶液中2c(Na+)>3c(RO32-)
B. 向b點溶液中加水可使溶液的pH由6.2升高到7.4
C. 常溫下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)
D. 當吸收RO2的溶液呈中性時,c(Na+)=2c(RO32-)+c(HRO3-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、Q為原子序數依次增大的前四周期元素,X核外未成對電子數有2個,與其他元素均能形成二元化合物;Y是地殼中含量最多的金屬元素;Z是遺傳物質的組成元素之一;W內層電子數是最外層電子數的9倍;Q基態原子價層電子排布中成對電子數和未成對電子數相同,且成對電子數為最外層電子數的2倍。據此回答下列問題:
(1)Q的基態原子的價層電子排布式為___________________________。
(2)X、Y、Z、W四種元素中,電負性最大的是_________(填元素符號,下同);同周期元素中,第一電高能介于Y和Z之間的有__________________。
(3)Y和W的氯化物熔點高的是______(填化學式),原因是_____________________;與Z的低價氯化物互為等電子體的離子是_______(填離子符號)。
(4)咖啡因對中樞神經有興奮作用,其結構簡式如圖所示。常溫下,咖啡因在水中的溶解度為2g,加適量水楊酸鈉[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________,分子中氮原子的雜化類型有___________________。

(5)已知WX的密度為3.25g/cm3,單元晶胞邊長481pm,經計算可確定該單元晶胞中含有____個WX,說明在形成晶體時,半徑大的粒子先進行了_______方式的堆積,晶胞中距離W最近的X有_____個。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某草酸晶體的化學式可表示為H2C2O4xH2O,為測定x的值,進行下列實驗: ①稱取7.56g某草酸晶體配成100.0mL的水溶液,
②用移液管移取25.00mL所配溶液置于錐形瓶中,加入適量稀H2SO4 , 用濃度為0.600mol/L的KMnO4溶液滴定,滴定終點時消耗KMnO4 的體積為10.00mL.
(1)若滴定終點時仰視讀數,則所測x的值將(填“偏大”或“偏小”).
(2)x= .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下S2Cl2是橙黃色液體,其分子結構如圖所示.少量泄漏會產生窒息性氣味,遇水易水解,并產生酸性懸濁液.下列關于S2Cl2的說法錯誤的是( ) 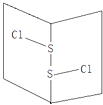
A.為非極性分子
B.分子中既含有極性鍵又含有非極性鍵
C.與S2Br2結構相似,熔沸點S2Br2>S2Cl2
D.與水反應的化學方程式可能為2S2Cl2+2H2O→SO2↑+3S↓+4HCl
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com