
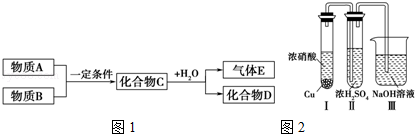
分析 (1)若C是離子化合物,D是一種強(qiáng)堿,C為Na2O2,D為NaOH,E為O2,A、B分別為氧氣、Na中的一種;
(2)若E的水溶液呈弱酸性,D是既能溶于強(qiáng)酸、又能溶于強(qiáng)堿的化合物,C為Al2S3,E為H2S,D為Al(OH)3,A、B分別為Al、S中的一種;
(3)若C是一種氣體,D是一種強(qiáng)酸,C為NO2,D為HNO3,E為NO,據(jù)此解答.
解答 解:(1)若C是離子化合物,D是一種強(qiáng)堿,C為Na2O2,D為NaOH,E為O2,A、B分別為氧氣、Na中的一種,過(guò)氧化鈉可以用作供氧劑、漂白劑、氧化劑等,
故答案為:Na2O2;供氧劑、漂白劑、氧化劑;
(2)若E的水溶液呈弱酸性,D是既能溶于強(qiáng)酸、又能溶于強(qiáng)堿的化合物,C為Al2S3,E為H2S,D為Al(OH)3,A、B分別為Al、S中的一種,則:
①用電離方程式解釋D既能溶于強(qiáng)酸、又能溶于強(qiáng)堿的原因:H++H2O+AlO2-═Al(OH)3═Al3++3OH-,
故答案為:H++H2O+AlO2-═Al(OH)3═Al3++3OH-;
②H2S與NaOH溶液反應(yīng)生成正鹽為Na2S,溶液中硫離子水解,用電荷守恒的等式表示溶液中所有離子的濃度之間的關(guān)系為:c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-),
故答案為:c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-);
(3)若C是一種氣體,D是一種強(qiáng)酸,C為NO2,D為HNO3,E為NO,則:
①C與水反應(yīng)的化學(xué)方程式為:3NO2+H2O═2HNO3+NO,
故答案為:3NO2+H2O═2HNO3+NO;
②常溫下物質(zhì)A與物質(zhì)B生成1mol氣體C的△H為-57kJ•mol-1,則:
反應(yīng)的熱化學(xué)方程式為:①2NO(g)+O2(g)=2NO2(g)△H=-114kJ•mol-1,
1mol氣體C與H2O反應(yīng)生成D溶液和E氣體的△H為-46kJ•mol-1,
反應(yīng)的熱化學(xué)方程式為:②3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138 kJ•mol-1,
則①×3+②×2得4NO(g)+3O2(g)+2H2O(1)=4HNO3 (aq);△H=3×(114kJ•mol-1)+2×(-138 kJ•mol-1)=-618kJ•mol-1,
故答案為:4NO(g)+3O2(g)+2H2O(1)=4HNO3 (aq)△H=-618kJ•mol-1;
③由現(xiàn)象實(shí)驗(yàn)過(guò)程中,濃H2SO4中未發(fā)現(xiàn)有氣體逸出,可以得出NO2能溶于濃硫酸中,
故答案為:NO2能溶于濃H2SO4,因而不能用濃H2SO4干燥NO2;
④用鉑做電極電解H2SO4的溶液,陽(yáng)極發(fā)生氧化反應(yīng),氫氧根離子在陽(yáng)極放電生成氧氣,其陽(yáng)極的電極反應(yīng)式為:4OH--4e-═O2↑+2H2O,
故答案為:4OH--4e-═O2↑+2H2O.
點(diǎn)評(píng) 本題考查無(wú)機(jī)物的推斷,屬于開(kāi)放性題目,需要學(xué)生熟練掌握元素化合物知識(shí),題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學(xué)生10分鐘應(yīng)用題系列答案
小學(xué)生10分鐘應(yīng)用題系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | Na2O2是淡黃色固體,久置于空氣中變成Na2O | |
| B. | Na2O2與水的反應(yīng)中,Na2O2只作氧化劑 | |
| C. | 用0.1mol Na2O2與足量水反應(yīng)轉(zhuǎn)移的電子的物質(zhì)的量為0.2mol | |
| D. | Na2O2放入飽和NaOH溶液中,放出大量的O2,并有白色固體析出 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | 離子半徑:丁>丙>乙 | |
| B. | 81號(hào)元素鉈與丙元素處同主族,則鉈的最高價(jià)氧化物對(duì)應(yīng)水化物呈兩性 | |
| C. | 電解法可以用乙與丙形成的化合物制得丙單質(zhì) | |
| D. | 同周期元素中丁的最高價(jià)氧化物對(duì)應(yīng)水化物的酸性最強(qiáng) |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | MgO | B. | Al2O3 | C. | SiO2 | D. | Cl2 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話(huà):027-86699610 舉報(bào)郵箱:58377363@163.com