
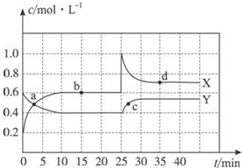
 已知NO2和N2O4可以相互轉化:2NO2(g)?N2O4(g)△H<0.現將一定量NO2和N2O4的混合氣體通入一定體積為2L的恒溫密閉玻璃容器中,反應物濃度隨時間變化關系如圖.
已知NO2和N2O4可以相互轉化:2NO2(g)?N2O4(g)△H<0.現將一定量NO2和N2O4的混合氣體通入一定體積為2L的恒溫密閉玻璃容器中,反應物濃度隨時間變化關系如圖.分析 (1)由2NO2(g)?N2O4(g),可知△c(NO2)=2△c(N2O4),結合圖象中物質濃度的變化量判斷;
可逆反應到達平衡時,各物質的濃度不發生變化;
可逆反應到達平衡時,同種物質的正逆速率相等且保持不變,各組分的濃度、含量保持不變,由此衍生的其它一些量不變,判斷平衡的物理量應隨反應進行發生變化,該物理量由變化到不再變化說明到達平衡;
(2))①根據v=$\frac{△c}{△t}$計算v(NO2);
②平衡常數指達到平衡時各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值,根據圖讀出平衡時各組分的平衡濃度,代入平衡常數表達式K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$計算;
(3)25min時,X的濃度增大,Y的濃度不變,只能是增大X的濃度,根據瞬間濃度變化計算加入二氧化氮的物質的量;d點與b點的溫度相同,溫度不變平衡常數不變;
(4)由圖可知,25 min時X的濃度突然增大,Y濃度不變,應是增大X的濃度,等效為增大壓強,平衡正向移動,到達新平衡時二氧化氮的含量減小.
A.使用催化劑不影響平衡移動;
B.縮小體積,壓強增大,平衡正向移動,二氧化氮含量減小;
C.正反應是放熱反應,升高溫度平衡逆向移動;
D.加入一定量的N2O4,等效為增大壓強,平衡正向移動.
解答 解:(1)由圖可知0-10min內,X的濃度變化量為(0.6-0.2)mol/L=0.4mol/L,Y的濃度變化量為(0.6-0.4)mol/L=0.2mol/L,由2NO2(g)?N2O4(g),可知△c(NO2)=2△c(N2O4),所以X表示NO2濃度隨時間的變化曲線,Y表示N2O4濃度隨時間的變化曲線;
由圖可知,10-25min及30min之后X、Y的物質的量不發生變化,則相應時間段內的點處于化學平衡狀態,故b、d處于化學平衡狀態;
A.隨反應進行混合氣體物質的量增大,恒溫恒容下壓強增大,容器內混合氣體的壓強不隨時間變化而改變,說明反應到達平衡,故A正確;
B.混合氣體總質量不變,容器容積不變,容器內混合氣體的密度為定值,故B錯誤;
C.容器內混合氣體的顏色不隨時間變化而改變,說明二氧化氮的濃度不變,反應到達平衡,故C正確;
D.混合氣體總質量不變,隨反應進行混合氣體物質的量增大,平均相對分子質量減小,當容器內混合氣體的平均相對分子質量不隨時間變化而改變,說明反應到達平衡,
故答案為:X;bd;B;
(2)①X表示NO2濃度隨時間的變化曲線,Y表示N2O4濃度隨時間的變化曲線.由圖可知,前10min內,NO2的濃度變化量為(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=$\frac{0.4mol/L}{10min}$=0.04mol•L-1•min-1,
故答案為:0.04;
②由圖可知,b點時各物質平衡濃度為c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L,所以b點的平衡常數K(b)=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=)=$\frac{0.4}{{0.6}^{2}}$=$\frac{10}{9}$,
故答案為:$\frac{10}{9}$;
(3)25min時,X的濃度增大,Y的濃度不變,只能是增大X的濃度,即增大NO2 的濃度,加入二氧化氮的物質的量為2L×(1-0.6)mOl/L=0.8mol,即加入0.8molNO2,d點與b點的溫度相同,平衡常數只受溫度影響,溫度不變平衡常數不變,故K(d)=K(b),
故答案為:加入0.8molNO2;=;
(4)由圖可知,25 min時X的濃度突然增大,Y濃度不變,應是增大X的濃度,等效為增大壓強,平衡正向移動,到達新平衡時二氧化氮的含量減小,即d點二氧化氮含量小于10-25min平衡階段二氧化氮的含量.
A.使用催化劑不影響平衡移動,二氧化氮含量不變,故A錯誤;
B.縮小體積,壓強增大,平衡正向移動,二氧化氮含量減小,故B正確;
C.正反應是放熱反應,升高溫度平衡逆向移動,二氧化氮含量增大,故C錯誤;
D.加入一定量的N2O4,等效為增大壓強,平衡正向移動,二氧化氮含量減小,故D正確,
故答案為:BD.
點評 本題考查化學平衡計算與影響因素、化學平衡圖象等,(4)為易錯點,學生容易認為d點二氧化氮濃度大,則二氧化氮含量高,難度中等.


 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案 暑假作業安徽少年兒童出版社系列答案
暑假作業安徽少年兒童出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 澄清石灰水與鹽酸反應:Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 鈉與水的反應:Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2SiO3溶液中通入過量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 大理石溶于醋酸的反應:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可逆反應的特征是正反應速率和逆反應速率相等 | |
| B. | 在其他條件不變時,使用催化劑只能改變反應速率,而不能改變化學平衡狀態 | |
| C. | 在其他條件不變時,升高溫度可以使平衡向正反應方向移動 | |
| D. | 對于反應A(g)+3B(g)?2C(g)△H<0達平衡后,溫度降低,正反應速率增大,逆反應速率減小,平衡向正反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | B的平均消耗速率為0.3mol(L•min) | |
| B. | C的平衡濃度為2mol/L | |
| C. | 平衡后,增大壓強,平衡將向正方向移動 | |
| D. | 若單位時間內生成的B和C的物質的量之比為3:2,則體系處于平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 .下列關于有機物
.下列關于有機物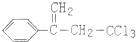 (除草劑,俗稱稗草烯)的說法不正確的是( )
(除草劑,俗稱稗草烯)的說法不正確的是( )| A. | 能使酸性高錳酸鉀溶液褪色 | |
| B. | 在足量NaOH溶液中充分水解,可生成羧酸鈉 | |
| C. | 可用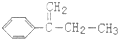 與Cl2在光照條件下通過取代反應獲得較純的該物質 與Cl2在光照條件下通過取代反應獲得較純的該物質 | |
| D. | 在一定條件下可發生聚合反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com