
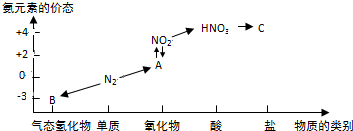
分析 由N元素化合價及對應物質種類,可知B為氨氣、A為NO、C為硝酸鹽.
(1)氮氣不活潑且性質較穩定,可以做保護氣;
(2)C為硝酸鹽,HNO3與物質C常用于檢驗Cl-的存在,則C為硝酸銀;
(3)B為氨氣,實驗室用氯化銨與氫氧化鈣制備氨氣,反應生成氯化鈣、氨氣與水;
(4)A為NO,二氧化氮與水反應生成硝酸與NO;
(5)(ⅰ) Cu與濃HNO3反應書寫硝酸銅、NO2與水;所含元素化合價升高的物質發生氧化反應,氧化劑得到電子,硝酸是氧化劑,結合N元素化合價變化計算轉移電子;
(ⅱ) Cu與硝酸反應生成Cu(NO3)2、NO2、NO,根據Cu元素守恒計算n[Cu(NO3)2],根據N元素守恒計算反應中消耗HNO3的物質的量;
(ⅲ) 所給的物質中,HNO3中氮元素化合價位于最高價,具有氧化性,對應還原產物為N2O,能將還原性的FeSO4氧化為Fe2(SO4)3、Fe(NO3)3;根據電子轉移守恒、電荷守恒、原子守恒配平離子方程式;
(ⅳ) A.銅與硝酸反應會產生一氧化氮、二氧化氮;
B.N元素被完全利用,沒有污染物生成,該途徑符合綠色化學原理;
C.氧化銅與水不反應;
D.銅與稀硫酸不反應,不能制得硫酸銅;銅與濃硫酸反應會產生二氧化硫氣體.
解答 解:由N元素化合價及對應物質種類,可知B為氨氣、A為NO、C為硝酸鹽.
(1)氮氣不活潑且性質較穩定,所以可作保護氣,能保存糧食,可以制備氨氣等,故答案為:做保護氣、保存糧食等;
(2)C為硝酸鹽,用AgNO3、HNO3檢驗Cl-的存在,則C為硝酸銀,故答案為:AgNO3;
(3)B為氨氣,實驗室用氯化銨與氫氧化鈣制備氨氣,反應生成氯化鈣、氨氣與水,反應方程式為:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案為:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)A為NO,二氧化氮與水反應生成硝酸與NO,反應方程式為:3NO2+H2O=2HNO3+NO,故答案為:3NO2+H2O=2HNO3+NO;
(5)(ⅰ) Cu與濃HNO3反應生成硝酸銅、二氧化氮和水,化學方程式為:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O,該反應中銅元素的化合價升高,發生氧化反應,硝酸中氮元素的化合價由+5價降為+4,作氧化劑,1 mol氧化劑得到1mol電子,
故答案為:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O;Cu;得到;1;
(ⅱ)n(NO2)+n(NO)=$\frac{22.4L}{22.4L/mol}$=1mol,即被還原的硝酸的物質的量為1mol,48.0 g Cu的物質的量為$\frac{48g}{64g/mol}$=0.75mol,則生成n(Cu(NO3)2)=0.75mol,可知表現酸性的硝酸的物質的量為0.75mol×2=1.5mol,則參加反應的硝酸的物質的量為:1mol+1.5mol=2.5mol,故選:C;
(ⅲ) 所給的物質中,HNO3中氮元素化合價位于最高價,具有氧化性,對應還原產物為N2O,能將還原性的FeSO4氧化為Fe2(SO4)3、Fe(NO3)3,故發生的反應為:HNO3+FeSO4→Fe(NO3)3+Fe2(SO4)3+N2O↑+H2O,配平后的離子方程式:8Fe2++2NO3-+10H+=8Fe3++N2O↑+5H2O;
故答案為:FeSO4、Fe(NO3)3+Fe2(SO4)3;8、2、10、8、1、5;
(ⅳ) A.銅與硝酸反應會產生一氧化氮、二氧化氮等大氣污染物,故A錯誤;
B.N元素被完全利用,沒有污染物生成,該途徑符合綠色化學原理,故B正確;
C.該流程中氧化銅與水不反應,不能制得硝酸銅,故C錯誤;
D.該途徑中銅與稀硫酸不反應,不能制得硫酸銅;銅與濃硫酸反應會產生二氧化硫氣體,污染大氣,故D錯誤,
故選:B.
點評 本題比較綜合,屬于拼合型題目,涉及氮元素單質化合物的性質、氨氣制備、氧化還原反應配平、化學計算、綠色化學等,需要學生具備扎實的基礎,側重考查學生對知識的遷移應用,難度中等.


科目:高中化學 來源: 題型:多選題
| A. | 在0.1 mol•L-1Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| B. | pH=2的醋酸溶液與pH=12的NaOH溶液等體積混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| C. | 將0.1 mol•L-1鹽酸與0.1 mol•L-1K2CO3溶液等體積混合:c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 向0.1 mol•L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2:3:2 | B. | 2:3:3 | C. | 1:3:2 | D. | 3:1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Ca2+、Cl-、HCO3- | B. | Mg2+、Na+、SO42-、Cl- | ||
| C. | K+、Na+、NO3-、MnO4- | D. | NH4+、Al3+、NO3-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 和化學式中M分別代表陽離子,圖中
和化學式中M分別代表陽離子,圖中 和化學式中N分別代表陰離子,則化學式為MN的晶體結構為( )
和化學式中N分別代表陰離子,則化學式為MN的晶體結構為( )| A. | 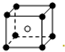 | B. | 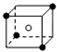 | C. | 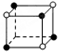 | D. | 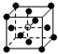 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
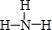 .
. ;一種由B、C組成的化合物與AC2電子總數相等,其化學式為N2O.
;一種由B、C組成的化合物與AC2電子總數相等,其化學式為N2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用食醋除去暖水瓶中的水垢 | |
| B. | 用熱的純堿溶液洗滌餐具上的油 | |
| C. | 用米湯檢驗食鹽中是否含碘酸鉀 | |
| D. | 用灼燒并聞氣味的方法區別純棉和純羊毛織物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
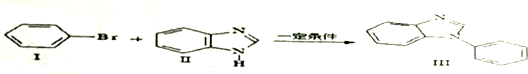
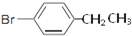 、
、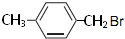 .
.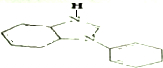 .
.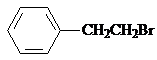 ,Ⅴ與氫氧化鈉醇溶液加熱條件下反應的方程式為:
,Ⅴ與氫氧化鈉醇溶液加熱條件下反應的方程式為: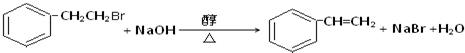 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com