
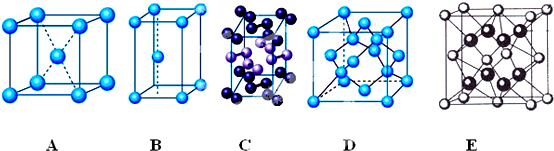
分析 (1)冰是分子晶體,冰的構成微粒是分子,利用晶胞圖來判斷晶體的構成微粒;
(2)丙醛和新制氫氧化銅懸濁液在加熱條件下發生氧化反應生成丙酸、氧化亞銅和水.
解答 解:(1)冰屬于分子晶體,構成微粒為水分子,由晶胞圖可知,鈉為簡單立方堆積、碘分子含有兩個原子且碘為分子晶體、金剛石中每個C原子形成四個共價鍵、氟化鈣為離子晶體且鈣離子配位數是8、鋅是六方最密堆積,所以A為Na的晶胞、B是鋅的晶胞、C是碘的晶胞、D是金剛石晶胞、E是氟化鈣晶胞,冰是分子晶體,構成微粒是分子,但每個O原子能和兩個H原子形成兩個共價鍵、和另外兩個H原子形成氫鍵,所以每個O原子和四個H原子形成正四面體結構,與金剛石結構相似,故選D;
(2)丙醛和新制氫氧化銅懸濁液在加熱條件下發生氧化反應生成丙酸、氧化亞銅和水,反應方程式為CH3CH2CHO+2Cu(OH)2$\stackrel{△}{→}$CH3CH2COOH+Cu2O↓+2H2O,
故答案為:CH3CH2CHO+2Cu(OH)2$\stackrel{△}{→}$CH3CH2COOH+Cu2O↓+2H2O.
點評 本題考查化學方程式的書寫、晶體類型判斷,為高頻考點,明確物質性質及晶體構成微粒是解本題關鍵,熟記有代表性物質晶胞結構及其配位數,題目難度中等.


科目:高中化學 來源: 題型:選擇題

| A. | 化學鍵的斷裂和行成是物質在化學反應中發生能量變化的主要原因 | |
| B. | 水分解生成氫氣跟氧氣的同時吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2 反應生成1mol H2O釋放能量一定為245kJ | |
| D. | 2mol H2(g)跟1mol O2 (g)反應生成2mol H2O(g)釋放能量490kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應后溶液中不存在任何沉淀,所以反應前后Cu2+的濃度不變 | |
| B. | 在[Cu(NH3)4]2+離子中,Cu2+提供空軌道,NH3提供孤對電子 | |
| C. | 沉淀溶解后將生成深藍色的正四面體形的配離子[Cu(NH3)4]2+ | |
| D. | 加入極性較小的溶劑乙醇后,將析出[Cu(H2O)4]SO4•H2O晶體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3穩定 | |
| C. | 氯化鈣能與Na2CO3反應,也能與NaHCO3反應 | |
| D. | 與足量鹽酸反應要得到相同質量的CO2,用NaHCO3比Na2CO3的質量要少 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學鍵是一種作用力 | |
| B. | 化學鍵可以使離子相結合,也可以使原子相結合 | |
| C. | 一種物質只含兩種非金屬元素,該物質中一定沒有非極性供價鍵 | |
| D. | 氫鍵屬于分子間作用力,不屬于化學鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | B. | $\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ | ||
| C. | $\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ | D. | $\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$、 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com