
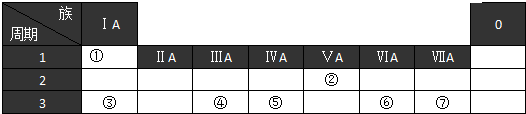
分析 根據元素在周期表中的位置知,①-⑦分別是H、N、Na、Al、Si、S、Cl元素;
(1)該元素的硅元素;
(2)同一周期元素,原子半徑隨著原子序數增大而減小;同一主族元素,原子半徑隨著原子序數增大而增大,所以原子電子層數越多其原子半徑越大;
(3)元素②氫化物是氨氣、其最高價氧化物的水化物是硝酸,氨氣和硝酸反應生成硝酸銨;
(4)③和④的最高價氧化物的水化物分別是NaOH、氫氧化鋁,二者反應生成偏鋁酸鈉和水;
(5)元素的非金屬性越強,其最高價氧化物的水化物酸性越強.
解答 解:根據元素在周期表中的位置知,①-⑦分別是H、N、Na、Al、Si、S、Cl元素;
(1)該元素的硅元素,元素符號為Si,故答案為:Si;
(2)同一周期元素,原子半徑隨著原子序數增大而減小;同一主族元素,原子半徑隨著原子序數增大而增大,所以原子電子層數越多其原子半徑越大,所以原子半徑最小的位于周期表左上角、原子半徑最大的位于周期表左下角,則原子半徑最小的是H、最大的是Na,故答案為:H;Na;
(3)元素②氫化物是氨氣、其最高價氧化物的水化物是硝酸,氨氣和硝酸反應生成硝酸銨,離子方程式為NH3+H+=NH4+,故答案為:NH3+H+=NH4+;
(4)③和④的最高價氧化物的水化物分別是NaOH、氫氧化鋁,二者反應生成偏鋁酸鈉和水,離子方程式為Al(OH)3+OH-=AlO2-+2H2O,故答案為:Al(OH)3+OH-=AlO2-+2H2O;
(5)元素的非金屬性越強,其最高價氧化物的水化物酸性越強,非金屬性Cl>S,則其最高價氧化物的水化物酸性HClO4>H2SO4,故答案為:HClO4>H2SO4.
點評 本題考查元素周期表和元素周期律的綜合運用,為高頻考點,明確原子結構、元素周期表結構、元素周期律內涵是解本題關鍵,注意氫氧化鋁的兩性,題目難度不大.


 浙江名校名師金卷系列答案
浙江名校名師金卷系列答案科目:高中化學 來源: 題型:解答題
 某離子晶體晶胞結構如圖所示,x位于立方體的頂點,Y位于立方體中心.試分析:
某離子晶體晶胞結構如圖所示,x位于立方體的頂點,Y位于立方體中心.試分析:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能使甲基橙試液顯紅色的溶液中:Na+、NH4+、I-、NO3- | |
| B. | 能使苯酚變紫色的溶液:K+、Mg2+、I-、SO42- | |
| C. | 由水電離出來的c(H+)=1×10-13 mol•L-1的溶液中:K+、CO32-、Cl-、NO3- | |
| D. | 常溫下,$\frac{K_w}{{c({H^+})}}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 為了探究實驗室制氯氣過程中反應物與生成氯氣之間量的關系.設計了如圖所示的裝置
為了探究實驗室制氯氣過程中反應物與生成氯氣之間量的關系.設計了如圖所示的裝置查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇和乙酸的酯化反應不屬于取代反應 | |
| B. | 煤的干餾是物理變化 | |
| C. | 戊烷的同分異構體有三種 | |
| D. | 蛋白質、淀粉、油脂均屬于天然高分子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c (Na+)=c (HB-)+2 c (B2-)+c (H2B) | B. | c(Na+)=0.01 mol/L≥c (B2-) | ||
| C. | c (H+)•c (OH-)=10-14 | D. | c (Na+)+c (H+)=c(HB-)+c (B2-)+c (OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該飽和溶液的物質的量濃度為5.07mol•L-1 | |
| B. | 向該溶液中加入等體積的水之后溶液的質量分數小于13.25% | |
| C. | 25℃時,密度等于1.12g•cm-3的NaCl溶液是飽和溶液 | |
| D. | 將此溶液蒸發掉部分水,再恢復到20℃時,溶液密度一定大于1.12g•cm-3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com