
分析 (1)根據m=nM計算甲烷的質量,根據V=nVm計算甲烷體積,H原子物質的量為甲烷的4倍,再根據N=nNA計算氫原子數目;
(2)根據n=$\frac{V}{{V}_{m}}$計算HCl物質的量,再根據c=$\frac{n}{V}$計算溶液物質的量濃度;根據稀釋定律計算需要1.5mol•L-1的氯化鈉溶液的體積;
(3)根據各物質的物質的量以及分子中含有的原子個數來解答.
解答 解:(1)0.5molCH4的質量=0.5mol×16g/mol=8g;標準狀況下的體積為:22.4L/mol×0.5mol=11.2L;0.5mol甲烷分子中含有的氫原子的個數為:0.5mol×4×6.02×1023/mol=1.204×1024,
故答案為:8;11.2;1.204×1024;
(2)標準狀況下的HCl氣體4.48L,其物質的量是:22.4L÷22.4L/mol=1mol,若將這些HCl氣體溶于水,制成200ml溶液,其物質的量濃度是:c=1mol÷0.2L=5mol/L;
配制300 mL 0.5 mol•L-1氯化鈉溶液,需要1.5 mol•L-1的氯化鈉溶液的體積為300 mL×0.5 mol•L-1÷1.5 mol•L-1=100 mL,
故答案為:5mol/L;100;
(3)①0.5mol CO2含有的物質的量為0.5mol×3=1.5mol;
②標準狀況下22.4L 氣的物質的量為$\frac{22.4L}{22.4L/mol}$=1mol,則所含原子的物質的量為1mol×1=1mol;
③4℃18mL水的質量為18g,物質的量為$\frac{18g}{18g/mol}$=1mol,則所含原子的物質的量為1mol×3=3mol;
④0.2mol H2SO4含有的物質的量為:0.2mol×6=1.2mol;
所以所含原子的物質的量越大,則含有的原子數越多,則含有的原子數按由大到小順序排列的是③①④②,
故答案為:③①④②.
點評 本題考查了物質的量、物質的量濃度的計算,題目難度中等,明確物質的量與物質的量濃度、摩爾質量等之間的關系為解答關鍵,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:解答題
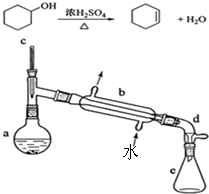 實驗室合成環己烯的反應和實驗裝置(夾持及加熱部分已省略)如圖:
實驗室合成環己烯的反應和實驗裝置(夾持及加熱部分已省略)如圖:| 相對分子數量 | 密度 | 沸點 | 溶解性 | |
| 環乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 環乙烯 | 82 | 0.8102 | 83 | 難溶于水 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 下列各組物質依次滿足如圖所示轉化關系的是(圖中箭頭表示一步轉化)( )
下列各組物質依次滿足如圖所示轉化關系的是(圖中箭頭表示一步轉化)( )| a | b | c | d | |
| ① | Si | SiO2 | H2SiO3 | Na2SiO3 |
| ② | N2 | NO | NO2 | HNO3 |
| ③ | Cu | CuO | Cu(OH)2 | CuSO4 |
| ④ | Na | NaCl | Na2CO3 | NaHCO3 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ② |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗 編號 | HA物質的量 濃度/(mol•L-1) | NaOH物質的量 濃度/(mol•L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鋁和氫氧化鉀都是重要的工業產品,請回答問題:
鋁和氫氧化鉀都是重要的工業產品,請回答問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com