
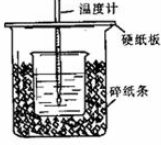
分析 (1)根據量熱計的構造來判斷該裝置的缺少儀器;根據中和熱的測定原理分析;
(2)中和熱測定實驗成敗的關鍵是保溫工作;
(3)不蓋硬紙板,會有一部分熱量散失;
(4)反應放出的熱量和所用酸以及堿的量的多少有關,并根據中和熱的概念和實質來回答;
(5)根據弱電解質電離吸熱分析;要保證一種物質完全反應,需另一種物質過量;
(6)準確測量中和熱的實驗過程,一般要測三次溫度;先根據Q=m•c•△T計算反應放出的熱量,然后根據△H=-$\frac{Q}{n}$kJ/mol計算出反應熱.
解答 解:(1)由量熱計的構造可知該裝置的缺少儀器是環形玻璃攪拌棒;中和熱測定實驗成敗的關鍵是保溫工作,內外燒杯為一樣高,否則,熱量散失大;
故答案為:環形玻璃攪拌棒;小燒杯口和大燒杯口沒有平齊;
(2)中和熱測定實驗成敗的關鍵是保溫工作,大小燒杯之間填滿碎紙條的作用是減少實驗過程中的熱量損失,
故答案為:減少實驗過程中的熱量損失;
(3)大燒杯上如不蓋硬紙板,會有一部分熱量散失,求得的中和熱數值將會減小,
故答案為:偏小;
(4)反應放出的熱量和所用酸以及堿的量的多少有關,改用60mL 0.50mol/L鹽酸跟50mL 0.55mol/L NaOH溶液進行反應,與上述實驗相比,生成水的量增多,所放出的熱量偏高,但是中和熱的均是強酸和強堿反應生成1mol水時放出的熱,中和熱相等;
故答案為:不相等;相等;
(5)氨水為弱堿,電離過程為吸熱過程,所以用氨水代替稀氫氧化鈉溶液反應,反應放出的熱量偏小;用50mL 0.50mol/L NaOH與50mL 0.50mol/L鹽酸反應,則二者不能完全反應,放出的熱量比理論值要小;
故答案為:偏小;偏小;
(6)溫度計要測反應前酸溶液的溫度,測反應前堿溶液的溫度,混合反應后測最高溫度一共3次,若共計做了三次實驗,則至少需測定溫度9次;50mL 0.50mol/L鹽酸與50mL 0.55mol/L NaOH溶液中和反應生成水的物質的量為0.05L×0.50mol=0.025mol,溶液的質量為:100ml×1g/ml=100g,溫度變化的值△T為(t2-t1),則生成0.025mol水放出的熱量為Q=m•c•△T=100g×4.18J/(g•℃)×(t2-t1)=418(t2-t1)J,即0.418(t2-t1)kJ,所以實驗測得的中和熱△H=-$\frac{0.418(t2-t1)kJ}{0.025mol}$;
故答案為:9;-$\frac{0.418(t2-t1)kJ}{0.025mol}$.
點評 本題考查學生中和熱測定,保溫工作是實驗成功的關鍵,掌握實驗原理即可解答,難度不大.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 過碳酸鈉(Na2CO4)在洗滌、印染、紡織、造紙、醫藥衛生等領域有大量應用.
過碳酸鈉(Na2CO4)在洗滌、印染、紡織、造紙、醫藥衛生等領域有大量應用.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳酸氫鈉的電離方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ | |
| B. | 用銅做陽極電解氯化銅溶液的離子方程式:Cu2++2Cl-$\frac{\underline{\;電解\;}}{\;}$Cu+Cl2↑ | |
| C. | 硫化鈉水解的離子方程式:S2-+2H2O═H2S+2OH- | |
| D. | 用TiCl4制備TiO2的化學方程式:TiCl4+(x+2)H2O(過量)?TiO2•x H2O↓+4HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 熱激活電池可用作火箭、導彈的工作電源.該電池以Ca為負極,熔融無水LiCl-KCl混合物作電解質,結構如下圖所示.正極反應式為PbSO4+2Li++2e-=Li2SO4+Pb.下列說法不正確的是( )
熱激活電池可用作火箭、導彈的工作電源.該電池以Ca為負極,熔融無水LiCl-KCl混合物作電解質,結構如下圖所示.正極反應式為PbSO4+2Li++2e-=Li2SO4+Pb.下列說法不正確的是( )| A. | 放電過程中,Li+向正極移動 | |
| B. | 常溫下電解質是不導電的固體,電池不工作 | |
| C. | 每轉移0.1 mol 電子,理論上生成20.7 g Pb | |
| D. | 該電池總反應為 PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | OCS、CO、CO2、S四種物質的晶體類型相同 | |
| B. | OCS在高溫下分解時,碳元素化合價升高 | |
| C. | OCS分子中含有2個σ鍵和2個π鍵,它們均屬于非極性鍵 | |
| D. | 22.4 L OCS中約含有3×6.02×1023個原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容量瓶中的原有蒸餾水未除去 | |
| B. | 溶解用的燒杯未經洗滌 | |
| C. | 定容時觀察液面俯視 | |
| D. | 用膠頭滴管向容量瓶加水時,水未到刻度線即停止加水 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com