
【題目】化學小組用如下方法測定經處理后的廢水中苯酚的含量(廢水中不含干擾測定的物質)。
Ⅰ.用已準確稱量的KBrO3固體配制一定體積的a mol·L1 KBrO3標準溶液;
Ⅱ.取v1 mL上述溶液,加入過量KBr,加HSO4酸化,溶液顏色呈棕黃色;
Ⅲ.向Ⅱ所得溶液中加入v2 mL廢水;
Ⅳ.向Ⅲ中加入過量KI;
Ⅴ.用b mol·L1 Na2S2O3標準溶液滴定Ⅳ中溶液至淺黃色時,滴加2滴淀粉溶液,繼續滴定至終點,共消耗Na2S2O3溶液v2 mL。
已知:I2+2Na2S2O3=2NaI+ Na2S4O6
Na2S2O3和Na2S4O6溶液顏色均為無色
(1)Ⅰ中配制溶液用到的玻璃儀器有燒杯、玻璃棒、膠頭滴管和____________。
(2)Ⅰ中發生反應的離子方程式是_______________________________。
(3)Ⅲ中發生反應的化學方程式是_________________________________。
(4)Ⅳ中加KI前,溶液顏色須為黃色,原因是______________________________。
(5)KI與KBrO3物質的量關系為n(KI)≥6n(KBrO3)時,KI一定過量,理由是________。
(6)Ⅴ中滴定至終點的現象是_____________________________。
(7)廢水中苯酚的含量為___________g·L1(苯酚摩爾質量:94 g·mol 1)。
(8)由于Br2具有____________性質,Ⅱ~Ⅳ中反應須在密閉容器中進行,否則會造成測定結果偏高。
【答案】容量瓶、量筒 BrO3- + 5Br- + 6H+ = 3Br2 + 3H2O  Ⅱ中生成的Br2與廢水中苯酚完全反應后,Ⅲ中溶液顏色為黃色,說明有Br2剩余,剩余Br2與過量KI反應生成I2可利用后續滴定法測量,從而間接計算苯酚消耗的Br2 Ⅱ中反應為KBrO3 + 5KBr + 3H2SO4=3K2SO4+ 3Br2 + 3H2O可知3n(KBrO3)=n(Br2),Ⅱ中Br2部分與苯酚反應,剩余溴在Ⅳ中反應為Br2+2KI=I2+2KBr,若剩余溴完全反應,則n(KI)≥ 2n(Br2),推知n(KI)≥6n(KBrO3) 當滴入最后一滴Na2S2O3標準溶液時,溶液由藍色變為無色,且30s不變色
Ⅱ中生成的Br2與廢水中苯酚完全反應后,Ⅲ中溶液顏色為黃色,說明有Br2剩余,剩余Br2與過量KI反應生成I2可利用后續滴定法測量,從而間接計算苯酚消耗的Br2 Ⅱ中反應為KBrO3 + 5KBr + 3H2SO4=3K2SO4+ 3Br2 + 3H2O可知3n(KBrO3)=n(Br2),Ⅱ中Br2部分與苯酚反應,剩余溴在Ⅳ中反應為Br2+2KI=I2+2KBr,若剩余溴完全反應,則n(KI)≥ 2n(Br2),推知n(KI)≥6n(KBrO3) 當滴入最后一滴Na2S2O3標準溶液時,溶液由藍色變為無色,且30s不變色 ![]() 揮發
揮發
【解析】
本題考查氧化還原反應滴定的綜合運用。苯酚與溴反應快速靈敏,但滴定終點難以判斷,因而制得一定量的溴分別與苯酚和KI反應(溴須完全反應完),而溴與KI反應生成的I2與Na2S2O3進行滴定分析,因而直接測出與KI反應所消耗的溴,進而計算出與苯酚反應消耗的溴,最后根據苯酚與溴反應的系數計算廢水中苯酚的濃度。
(1)準確稱量KBrO3固體配置溶液所需的玻璃儀器有燒杯、量筒、玻璃棒、膠頭滴管,一定規格的容量瓶,因而該空填容量瓶、量筒;
(2)KBrO3溶液中加入KBr和H2SO4,溶液顏色呈棕黃色,說明生成Br2,根據缺項配平可知該離子方程式為BrO3- + 5Br- + 6H+ = 3Br2 + 3H2O;
(3)苯酚和溴水反應得到白色沉淀2,4,6-三溴苯酚,化學方程式為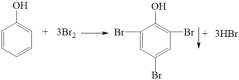 ;
;
(4)該測量過程是利用一定量的溴分別與苯酚和KI反應,注意溴須反應完全,且一定量溴的總量已知,部分溴與KI反應生成的I2可利用氧化還原滴定法測量,進而計算出與KI反應的溴的消耗量,將一定量溴減去與KI反應的溴的消耗量,可得與苯酚反應的溴的消耗量,因而一定量的溴與苯酚反應完,必須有剩余的溴與KI反應,Ⅲ中反應結束時,若溶液顯黃色說明苯酚反應完,且有溴剩余,以便與KI反應,故原因為Ⅱ中生成的Br2與廢水中苯酚完全反應后,Ⅲ中溶液顏色為黃色,說明有Br2剩余,剩余Br2與過量KI反應,從而間接計算苯酚消耗的Br2;
(5)Ⅱ中反應為KBrO3 + 5KBr + 3H2SO4=3K2SO4+ 3Br2 + 3H2O可知3n(KBrO3)=n1(Br2),Ⅱ中Br2部分與苯酚反應,剩余溴的量設為n2(Br2)(n1(Br2)>n2(Br2))在Ⅳ中反應為Br2+2KI=I2+2KBr,若剩余溴完全反應,則n(KI)≥ 2n2(Br2),推知n(KI)≥6n(KBrO3);因而當n(KI)≥6n(KBrO3),KI一定過量;
(6)Ⅴ中含碘的溶液內加入淀粉,溶液顯藍色,隨著Na2S2O3溶液滴入,藍色變淺直至消失,因而當滴入最后一滴Na2S2O3標準溶液時,溶液由藍色變為無色,且30s不變色;
(7)n(BrO3-)=av1×10-3mol,根據反應BrO3- + 5Br- + 6H+ = 3Br2 + 3H2O可知n(Br2)=3av1×10-3mol,溴分別與苯酚和KI反應,先計算由KI消耗的溴的量,設為n1(Br2),根據I2+2Na2S2O3=2NaI+Na2S4O6可知I2~2Na2S2O3,又Br2+2I-=I2+2Br-可知Br2~ I2,可得Br2~2Na2S2O3,n(Na2S2O3)= bv3×10-3mol,n1(Br2)=![]() bv3×10-3mol,再計算由苯酚消耗的溴的量,設為n2(Br2)= n(Br2)- n1(Br2)=( 3av1-
bv3×10-3mol,再計算由苯酚消耗的溴的量,設為n2(Br2)= n(Br2)- n1(Br2)=( 3av1-![]() bv3) ×10-3mol,苯酚與溴水反應的計量數關系為3Br2~C6H5OH,n(C6H5OH)=
bv3) ×10-3mol,苯酚與溴水反應的計量數關系為3Br2~C6H5OH,n(C6H5OH)=![]() n2(Br2)=(av1-
n2(Br2)=(av1-![]() bv3)×10-3mol,廢水中苯酚的含量=
bv3)×10-3mol,廢水中苯酚的含量=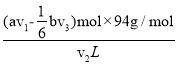 =
=![]() mol;
mol;
(8)Ⅱ中生成的溴須被苯酚和KI完全反應掉,而溴有揮發性,反應時須在密閉容器中進行。


 全優考典單元檢測卷及歸類總復習系列答案
全優考典單元檢測卷及歸類總復習系列答案 品學雙優卷系列答案
品學雙優卷系列答案 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】某研究性學習小組同學對由NaHCO3和KHCO3組成的某均勻混合物進行實驗,測得如下數據(鹽酸的物質的量濃度相等):
50mL鹽酸 | 50mL鹽酸 | 50mL鹽酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
標準狀況下,V(CO2) | 2.24L | 3.36L | 3.36L |
(1)鹽酸的物質的量濃度為_________。
(2)混合物中,n(NaHCO3):n(KHCO3)=_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式能用來解釋相應實驗現象的是( )
實驗現象 | 離子方程式 | |
A | 向氫氧化鎂懸濁液中滴加氯化銨溶液,沉淀溶解 |
|
B | 向沸水中滴加飽和氯化鐵溶液得到紅褐色液體 |
|
C | 二氧化硫使酸性高錳酸鉀溶液褪色 |
|
D | 氧化亞鐵溶于稀硝酸 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有四種短周期元素A,B,C,D,已知:①C,D在同一周期,A,B在同一主族;②它們可以組成化合物A2C、B2C2、DC2、D2A4等;③B的陽離子與C的陰離子的核外電子排布相同;④B2C2同A2C或DC2反應都生成氣體C2,B與A2C反應生成氣體A2,A2與氣體C2按體積比2∶1混合后點燃發生爆炸,其產物是一種常溫下常見的無色無味的液體。請回答:
(1)寫出元素符號:A________、B________、C________、D________。
(2)在A2C、B2C2、DC2和D2A4中,同時含有離子鍵和非極性共價鍵的化合物的電子式為__________;按原子軌道重疊方式,其非極性鍵的類型是________。化合物DC2的結構式__________。
(3)A2C分子的電子式____________,按原子軌道重疊方式,其共價鍵的類型是____________。D2A4是平面形分子,其分子中含有______個σ鍵,______個π鍵。
(4)寫出化學方程式或離子方程式:
B2C2與A2C反應的化學方程式:___________________________________________;
B2C2與DC2反應的化學方程式:___________________________________________;
B與A2C反應的離子方程式:______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】抗癌藥托瑞米芬的前體K的合成路線如下。

已知:
ⅰ. 
ⅱ.有機物結構可用鍵線式表示,如(CH3)2NCH2CH3的鍵線式為![]()
(1)有機物A能與Na2CO3溶液反應產生CO2,其鈉鹽可用于食品防腐。有機物B能與Na2CO3溶液反應,但不產生CO2;B加氫可得環己醇。A和B反應生成C的化學方程式是___________,反應類型是___________________________。
(2)D中含有的官能團:__________________。
(3)E的結構簡式為__________________。
(4)F是一種天然香料,經堿性水解、酸化,得G和J。J經還原可轉化為G。J的結構簡式為__________________。
(5)M是J的同分異構體,符合下列條件的M的結構簡式是__________________。
①包含2個六元環
②M可水解,與NaOH溶液共熱時,1 mol M最多消耗2 mol NaOH
(6)推測E和G反應得到K的過程中,反應物LiAlH4和H2O的作用是__________________。
(7)由K合成托瑞米芬的過程:
![]()
托瑞米芬具有反式結構,其結構簡式是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放熱且產生氣體,可用于冬天石油開采。下列表示反應中相關微粒的化學用語正確的是
NaCl+N2↑+2H2O放熱且產生氣體,可用于冬天石油開采。下列表示反應中相關微粒的化學用語正確的是
A. 中子數為18的氯原子:![]()
B. N2的結構式:N=N
C. Na+的結構示意圖: 
D. H2O的電子式: ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,下列各組離子在指定溶液中能大量共存的是
A. 0.1 mol·L1NaOH溶液:Na+、K+、![]() 、
、![]()
B. 0.1 mol·L1FeCl2溶液:K+、Mg2+、![]() 、
、![]()
C. 0.1 mol·L1K2CO3溶液:Na+、Ba2+、Cl、OH
D. 0.1 mol·L1H2SO4溶液:K+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2001年是偉大的化學家、1954年諾貝爾化學獎得主、著名的化學結構大師、20世紀的科學怪杰鮑林(L.Pauling)教授的誕辰100周年。1994年這位老人謝世后,人們打開他的辦公室,發現里面有一塊黑板,畫得滿滿的,其中一個結構式如圖所示。老人為什么畫這個結構式?它能合成嗎?它有什么性質?不得而知。這是鮑林留給世人的一個謎,也許這是永遠無法解開的謎,也許有朝一日你就能解開它。不管結果如何,讓我們先對這個結構作一番了解。

(1)它的分子式是__________________________________________________________。
(2)它的所有原子是否可能處于同一個平面上?________(填“可能”或“不可能”)。
(3)它是否帶有電荷?________(填“是”或“否”)。
(4)該分子中sp雜化的氮原子有___個;sp2雜化的氮原子有___個;sp3雜化的氮原子有_____個。
(5)為什么人們推測它是炸藥?______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Li4Ti5O12和LiFePO4都是鋰離子電池的電極材料,可利用鈦鐵礦(主要成分為FeTiO3,還含有少量MgO、SiO2等雜質)來制備,工藝流程如下:
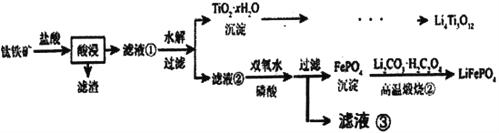
已知:“酸浸”后,鈦主要以TiOCl42-形式存在
FeTiO3+4H++4C1-=Fe2++ TiOCl42-+2H2O
下列說法不正確的是
A. Li2Ti5O15中Ti的化合價為+4,其中有4個過氧鍵
B. 濾液②中的陽離子除了Fe2+和H+,還有Mg2+
C. 濾液②中也可以直接加適量的氯水代替雙氧水
D. “高溫煅燒②”過程中,Fe元素被氧化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com