
【題目】2001年是偉大的化學家、1954年諾貝爾化學獎得主、著名的化學結構大師、20世紀的科學怪杰鮑林(L.Pauling)教授的誕辰100周年。1994年這位老人謝世后,人們打開他的辦公室,發現里面有一塊黑板,畫得滿滿的,其中一個結構式如圖所示。老人為什么畫這個結構式?它能合成嗎?它有什么性質?不得而知。這是鮑林留給世人的一個謎,也許這是永遠無法解開的謎,也許有朝一日你就能解開它。不管結果如何,讓我們先對這個結構作一番了解。

(1)它的分子式是__________________________________________________________。
(2)它的所有原子是否可能處于同一個平面上?________(填“可能”或“不可能”)。
(3)它是否帶有電荷?________(填“是”或“否”)。
(4)該分子中sp雜化的氮原子有___個;sp2雜化的氮原子有___個;sp3雜化的氮原子有_____個。
(5)為什么人們推測它是炸藥?______________________________________________。
【答案】C6H2O2N10 可能 否 1 9 0 它分解能產生大量很穩定的氣體N2
【解析】
(1)根據結構簡式書寫分子式;
(2)根據苯環的共面結構和氮原子的成鍵特點來確定該有機物的共面情況;
(3)根據原子的成鍵情況來確定電性;
(4)sp雜化的N原子表現為線型結構,sp2雜化N原子表現為三角錐結構;sp3雜化的N原子表現為四面體結構;
(5)產物中有大量的氮氣,而能量越低越穩定,放出的熱量越多。
(1)根據結構簡式書寫分子式為:C6H2O2N10,故答案為:C6H2O2N10;
(2)碳原子和氮原子均相當于有3個價電子對,根據價層電子對互斥理論,可知它們為平面三角型結構,由此推出碳原子和氮原子構成的環為平面結構,氧原子有4對電子對,它們排列方式為四面體結構,故與氧原子連接的氫原子也可能在該平面內,與環不直接相連的2個氮原子也可能在此平面內,所以它的所有原子可能處于同一個平面,故答案為:可能;
(3)所有的原子成鍵都達到了飽和,所以不帶電荷,故答案為:否;
(4)根據N原子的成鍵特點和結構,可知該分子中sp雜化的N原子只有![]() 結構的中間氮原子;其余的氮原子都是sp2雜化;沒有sp3雜化的,故答案為:1;9;0。
結構的中間氮原子;其余的氮原子都是sp2雜化;沒有sp3雜化的,故答案為:1;9;0。
(5)該物質分解會產生大量很穩定的氣體N2。從能量變化角度來看,生成物的能量越低,反應放出的能量越高,故答案為:它分解能產生大量很穩定的氣體N2。


 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:
【題目】絢麗多彩的無機顏料的應用曾創造了古代繪畫和彩陶的輝煌。硫化鎘(CdS)是一種難溶于水的黃色顏料,其在水中的沉淀溶解平衡曲線如圖所示。下列說法錯誤的是
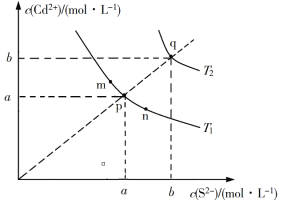
A. 圖中a和b分別為T1、T2溫度下CdS在水中的溶解度
B. 圖中各點對應的Ksp的關系為:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C. 向m點的溶液中加入少量Na2S固體,溶液組成由m沿mpn線向p方向移動
D. 溫度降低時,q點的飽和溶液的組成由q沿qp線向p方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學小組用如下方法測定經處理后的廢水中苯酚的含量(廢水中不含干擾測定的物質)。
Ⅰ.用已準確稱量的KBrO3固體配制一定體積的a mol·L1 KBrO3標準溶液;
Ⅱ.取v1 mL上述溶液,加入過量KBr,加HSO4酸化,溶液顏色呈棕黃色;
Ⅲ.向Ⅱ所得溶液中加入v2 mL廢水;
Ⅳ.向Ⅲ中加入過量KI;
Ⅴ.用b mol·L1 Na2S2O3標準溶液滴定Ⅳ中溶液至淺黃色時,滴加2滴淀粉溶液,繼續滴定至終點,共消耗Na2S2O3溶液v2 mL。
已知:I2+2Na2S2O3=2NaI+ Na2S4O6
Na2S2O3和Na2S4O6溶液顏色均為無色
(1)Ⅰ中配制溶液用到的玻璃儀器有燒杯、玻璃棒、膠頭滴管和____________。
(2)Ⅰ中發生反應的離子方程式是_______________________________。
(3)Ⅲ中發生反應的化學方程式是_________________________________。
(4)Ⅳ中加KI前,溶液顏色須為黃色,原因是______________________________。
(5)KI與KBrO3物質的量關系為n(KI)≥6n(KBrO3)時,KI一定過量,理由是________。
(6)Ⅴ中滴定至終點的現象是_____________________________。
(7)廢水中苯酚的含量為___________g·L1(苯酚摩爾質量:94 g·mol 1)。
(8)由于Br2具有____________性質,Ⅱ~Ⅳ中反應須在密閉容器中進行,否則會造成測定結果偏高。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A. 室溫下用稀NaOH溶液吸收Cl2:Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. 用鋁粉和NaOH溶液反應制取少量H2:Al+2OH![]()
![]() +H2↑
+H2↑
C. 室溫下用稀HNO3溶解銅:Cu+2![]() +2H+
+2H+![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀鹽酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】次磷酸(H3PO2)是一種精細磷化工產品,具有較強還原性。回答下列問題:
(1)H3PO2是一元中強酸,寫出其電離方程式____。
(2)H3PO2及NaH2PO2均可將溶液中的Ag+還原為銀,從而可用于化學鍍銀。
①H3PO2中P元素的化合價為___。
② 利用H3PO2進行化學鍍銀反應中,氧化劑與還原劑的物質的量之比為4∶1,則氧化產物為__________(填化學式)。
③從分類來看,NaH2PO2屬于______
a.正鹽 b.酸式鹽 c.鈉鹽 d.氧化物
(3)H3PO2的工業制法是:將白磷(P4)與Ba(OH)2溶液反應生成PH3氣體和Ba(H2PO2)2,后者再與H2SO4反應。寫出白磷與Ba(OH)2溶液反應的化學方程式_______Ba(H2PO2)2與H2SO4的離子方程式___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cu2+能與NH3、H2O、OH﹣、Cl﹣等形成配位數為4的配合物。
(1)向CuSO4溶液中加入過量NaOH溶液可生成Na2[Cu(OH)4]。
①畫出配離子[Cu(OH)4]2+中的配位鍵__。
②Na2[Cu(OH)4]中除了配位鍵外,還存在的化學鍵類型有__(填序號)。
A.離子鍵 B.金屬鍵 C.極性共價鍵 D.非極性共價鍵
(2)金屬銅單獨與氨水或過氧化氫都不能反應,但可與氨水和過氧化氫的混合溶液發生如下反應:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是_________________.
(3)Cu2+可以與乙二胺(H2N﹣CH2CH2﹣NH2)形成配離子(如圖):

①H、O、N三種元素的電負性從大到小的順序____。
②乙二胺分子中N原子成鍵時采取的雜化類型是__。
③乙二胺沸點高于Cl﹣CH2CH2﹣Cl的主要原因是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值。下列判斷正確的是
A. 標準狀況下,2.24L苯中含有碳碳雙鍵數為0.3NA
B. 6.4gS2、S4和S8的混合物中所含硫原子數為0.2NA
C. 1L0.1mol·L-1的氫碘酸中含碘化氫分子數為0.1NA
D. 60g乙酸與足量乙醇發生酯化反應時斷裂的C-O鍵數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組欲選用下列裝置和藥品制取純凈乙炔并進行有關乙炔性質的探究,試回答下列問題。

(1)A中制取乙炔的化學方程式為_______________________________________________。
(2)制乙炔時,旋開分液漏斗的活塞,使水緩慢滴下的原因是________________________,分液漏斗里的液體通常用___________________。
(3)用電石制得的乙炔中常含有H2S、PH3等雜質,除去雜質應選用________(填字母,下同)裝置,氣體應從________進;干燥乙炔最好選用________裝置。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是( )
A. 氯氣溶于水:Cl2+H2O2H++Cl﹣+ClO﹣
B. 向FeSO4溶液中加入H2SO4酸化的KMnO4溶液:5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O
C. 向少量澄清石灰水中加入足量的NaHCO3溶液:Ca2++OH﹣+HCO3﹣═CaCO3↓+H2O
D. 用銅做電極電解NaCl溶液:2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com