
| A. | 0.2molAl與足量NaOH溶液反應,生成的H2分子數為0.3NA | |
| B. | 常溫下,1LpH=1的鹽酸溶液,由水電離的H+離子數目為0.1NA | |
| C. | 鉛蓄電池中,當正極增加9.6g時,電路中通過的電子數目為0.2NA | |
| D. | 11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4 反應中,6 mol CuSO4能氧化白磷的分子數為1.1NA |
分析 A.鋁為3價金屬,0.2mol鋁與氫氧化鈉溶液完全反應失去0.6mol電子,根據電子守恒計算出生成氫氣的物質的量;
B.鹽酸抑制了水的電離,溶液中中的氫氧根離子是水電離的;
C.正極由PbO2→PbSO4,每增重64g轉移2mol電子;
D.Cu3P中Cu顯+1價,60mol CuSO4參加反應得到60mol電子,P4被氧化到H3PO4,每有1molP4被氧化失去電子20mol,故6 mol CuSO4能氧化0.3 mol 白磷.
解答 解:A.0.2mol鋁完全反應失去0.6mol電子,會生成$\frac{0.6mol}{2}$=0.3mol氫氣,則生成的H2分子數為0.3NA,故A正確;
B.常溫下,1LpH=1的鹽酸溶液中含有氫離子的物質的量濃度為:0.1mol/L,鹽酸抑制了水的電離,則溶液中的氫氧根離子是水電離的,水電離的氫離子濃度為:1×10-13mol/L,1L該溶液中由水電離的氫離子的物質的量為:1×10-13mol,故B錯誤;
C.鉛蓄電池中,正極:PbO2→PbSO4,每增重64g時轉移2mol電子,所以正極增重9.6g轉移電子數為0.3NA,故C錯誤;
D.Cu3P中Cu顯+1價,所以60 mol CuSO4參加反應得到60 mol 電子,P4被氧化到H3PO4,每有1 mol P4被氧化失去電子20 mol,所以6 mol CuSO4能氧化0.3 mol 白磷,能氧化白磷的分子數為0.3NA,故D錯誤;
故選A.
點評 本題考查阿伏伽德羅常數的計算與判斷,題目難度中等,涉及知識點較多、綜合性較強,充分考查學生的分析、理解能力及靈活應用基礎知識的能力,注意熟練掌握物質的量與阿伏伽德羅常數、摩爾質量等物理量之間的關系.


 高效智能課時作業系列答案
高效智能課時作業系列答案科目:高中化學 來源: 題型:選擇題
| A. | 溫度越高,催化劑的催化效果越好 | |
| B. | 汽車排氣管上的“催化轉化器”能減少有害氣體排放 | |
| C. | 催化劑可以改變化學反應速率,但不能破壞化學平衡 | |
| D. | 催化劑可以改變化學反應路徑,且反應前后其質量和化學性質都不發生變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
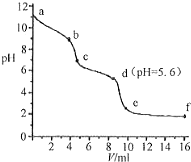 常溫下,將已知濃度的鹽酸滴定到未知濃度的Na2CO3溶液,用pH傳感器測得混合溶液的pH變化曲線,如圖所示:(已知飽和CO2溶液的pH為5.6)下列說法正確的是( )
常溫下,將已知濃度的鹽酸滴定到未知濃度的Na2CO3溶液,用pH傳感器測得混合溶液的pH變化曲線,如圖所示:(已知飽和CO2溶液的pH為5.6)下列說法正確的是( )| A. | a點時,溶液呈堿性的原因是CO32-發生水解反應,其離子方程式為:CO32-+2H2O=H2CO3+2OH- | |
| B. | a→b段,溶液有氣體放出 | |
| C. | c點以后,鹽酸過量 | |
| D. | d點溶液中c(Na+)=c(Cl-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 已知電解熔融氧化鈣可以得到金屬鈣和氯氣,鈣在氯氣中燃燒又能生成氯化鈣.請你根據已學知識,按圖中箭頭所表示的物質間可能發生的轉化,分析下列說法正確的是( )
已知電解熔融氧化鈣可以得到金屬鈣和氯氣,鈣在氯氣中燃燒又能生成氯化鈣.請你根據已學知識,按圖中箭頭所表示的物質間可能發生的轉化,分析下列說法正確的是( )| A. | CaO、Ca(OH)2、CaCO3三者都是離子化合物,在固態時可以導電 | |
| B. | 工業上也可用電解熔融氧化鈣的方法制備金屬鈣 | |
| C. | 往Ca(OH)2溶液中滴加Na2CO3溶液或NaHCO3溶液,都能實現⑥的轉化 | |
| D. | 工業上以氯氣和石灰乳為原料通過反應制造主要成分為CaCl2的漂白粉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可以通過過濾的方法將淀粉膠體中混有的氯化鈉溶液除去 | |
| B. | 在2mL10%的CuSO4(aq)中滴入3滴 2%的NaOH(aq),配制檢驗醛基的試劑 | |
| C. | 用托盤天平準確稱取14.80g Ca(OH)2,配制100mL 2.0 mol/L的Ca(OH)2溶液 | |
| D. | 乙酸乙酯中少量乙醇雜質可加水除去,其原理與溴水中加四氯化碳萃取溴類似 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 方案 | 實驗操作 | 現象 |
| Ⅰ | 將2mL 2mol/L Fe(NO3)3溶液加入有銀鏡的試管中 | 銀鏡較迅速消失 試管口產生紅棕色氣體 |
| Ⅱ | 將2mL2mol/L Fe2(SO4)3溶液加入有銀鏡的試管中 | 銀鏡減少但未消失 |
| Ⅲ | 將2mL 2mol/L FeCl3溶液加入有銀鏡的試管中 | 銀鏡較迅速消失 有白色沉淀生成 |
| A. | 方案Ⅰ說明Fe3+ 氧化了Ag | |
| B. | 方案Ⅱ涉及反應之一為Fe3++Ag?Fe2++Ag+ | |
| C. | 方案Ⅱ、Ⅲ對比說明SO42-比Cl-更易沉淀Ag+ | |
| D. | 三個方案對比說明方案Ⅰ是除去銀鏡的最佳方案 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com