
下列有關實驗敘述正確的是( )
A.向1 mol·L-1 AlCl3溶液中加過量的6 mol·L-1 NaOH溶液可制備Al(OH)3懸濁液
B.氣體通過無水CuSO4,粉末變藍,證明原氣體中含有水蒸氣
C.灼燒白色粉末,火焰呈黃色,證明原粉末中有Na+,無K+
D.向含有少量Fe3+的CuSO4溶液中加入銅片可除去Fe3+
 浙大優學小學年級銜接捷徑浙江大學出版社系列答案
浙大優學小學年級銜接捷徑浙江大學出版社系列答案科目:高中化學 來源:2015-2016學年河北武邑中學高一下第二次月考化學試卷(解析版) 題型:選擇題
在一定溫度下的恒容密閉容器中,當下哪些物理量不再發生變化時,表明下述反應:A(s)+2B(g)?C(g)+D(g)已達到平衡狀態
①混合氣體的壓強
②混合氣體的密度
③B的物質的量濃度
④氣體的總物質的量
⑤混合氣體的平均相對分子質量
⑥物質C的百分含量
⑦各氣體的物質的量
A.②③⑤⑥⑦ B.①②③⑥⑦ C.②③④⑤⑥ D.①③④⑤⑦
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省高一下第二次月考化學試卷(解析版) 題型:選擇題
一定溫度下,在2 L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖所示,描述正確的是( )
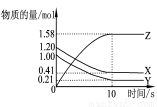
A.反應開始到10 s,用Z表示的反應速率為0.158 mo l/(L·s)
l/(L·s)
B.反應開始到10 s,X的物質的量濃度減 少了0.79 mol/L
少了0.79 mol/L
C.反應開始 到10 s時,Y的轉化率為79.0%
到10 s時,Y的轉化率為79.0%
D.反應的化學方程式為:X(g)+Y(g) Z(g)
Z(g)
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省高二下第二次月考化學試卷(解析版) 題型:填空題
某汽車安全氣囊的產氣藥劑主要含有NaN3、Fe2O3、KClO4、NaHCO3等物質。當汽車發生碰撞時,產氣藥劑產生大量氣體使氣囊迅速膨脹,從而起到保護作用。
(1)NaN3是氣體發生劑,受熱分解產生N2和Na,N2的電子式為________。
(2)Fe2O3是主氧化劑,與Na發生置換反應生成的還原產物為________。
(3)KClO4是助氧化劑,反應過程中與Na作用生成KCl和Na2O。KClO4含有化學鍵的類型為________,金屬晶體K的堆積方式為________。
(4)NaHCO3是冷卻劑,吸收產氣過程中釋放的熱量而發生分解,其化學方程式為______
__________________________________。
(5)100 g上述產氣藥劑產生的氣體通過堿石灰后得到N2 33.6 L(標準狀況)。
①用堿石灰除去的物質為________________;
②該產氣藥劑中NaN3的質量分數為________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省高二下第二次月考化學試卷(解析版) 題型:選擇題
工業上曾經通過反應“3Fe+4NaOH Fe3O4+2H2↑+4Na↑”生產金屬鈉。下列有關說法正確的是( )
Fe3O4+2H2↑+4Na↑”生產金屬鈉。下列有關說法正確的是( )
A.用磁鐵可以將Fe與Fe3O4分離
B.將生成的氣體在空氣中冷卻可獲得鈉
C.該反應條件下鐵的氧化性比鈉強
D.每生成1molH2,轉移的電子數約為4×6.02×1023
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖北省高二5月月考化學試卷(解析版) 題型:簡答題
(1)在其他條件不變的情況下,起始氫氣的物質的量[用n(H2)表示]對N2(g)+3H2(g) 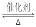 2NH3(g)反應的影響可表示成如圖所示的規律(圖中
2NH3(g)反應的影響可表示成如圖所示的規律(圖中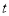 表示溫度,
表示溫度, 表示物質的量)。
表示物質的量)。

①比較在a、b、c三點處的平衡狀態中,反應物N2的轉化率最高的是__________。
②若容器容積為1L,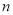 =3mol,反應達到平衡時H2的轉化率為60%,則在起始時體系中加入N2的物質的量為__________mol,此條件下(t2)反應的平衡常數
=3mol,反應達到平衡時H2的轉化率為60%,則在起始時體系中加入N2的物質的量為__________mol,此條件下(t2)反應的平衡常數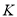 =________。
=________。
③圖像中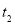 和
和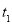 的關系是t2 ______ t1(填“高于”“低于”“等于”或“無法確定”)。
的關系是t2 ______ t1(填“高于”“低于”“等于”或“無法確定”)。
(2)氨氣和氧氣與145 時開始反應,在不同溫度和催化劑條件下生成不同產物(如圖所示)
時開始反應,在不同溫度和催化劑條件下生成不同產物(如圖所示)

4NH3+5O2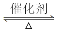 4NO+6H2O
4NO+6H2O
4NH3+3O2 2N2+6H2O
2N2+6H2O
溫度較低時以生成________為主,溫度高于900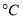 時,NO產率下降的原因是______。
時,NO產率下降的原因是______。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖北省高二5月月考化學試卷(解析版) 題型:選擇題
下列說法不正確的是( )
A.若0.5molCH4全部和Cl2發生取代反應,生成物質的量相等的四種有機物,則消耗Cl2的物質的量是1.25mol
B.將CH3OH和分子式為C3H8O的醇混合,發生分子間脫水反應,可以得到的醚有6種
C.工業上要生產氯乙烷,用CH3CH3與Cl2發生取代反應制取比用CH2=CH2與HCl發生加成反應制取好
D.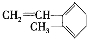 與Br2發生1:1加成反應,其加成產物最多有5種
與Br2發生1:1加成反應,其加成產物最多有5種
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧東北育才學校高一下第二段考化學試卷(解析版) 題型:選擇題
固體氧化物燃料電池(SOFC)以固體氧化物作為電解質.其工作原理如圖所示:下列關于固體燃料電池的有關說法正確的是( )
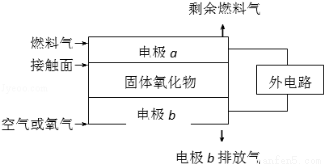
A.電極b為電池負極,電極反應式為2O2+4e﹣=4O2﹣
B.固體氧化物的作用是讓電子在電池內通過
C.若H2作為燃料氣,則接觸面上發生的反應為H2+2OH﹣﹣4e﹣=2H++H2O
D.若C2H4作為燃料氣,則接觸面上發生的反應為C2H4+6O2﹣﹣12e﹣=2CO2+2H2O
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江哈爾濱六中高三下三模理綜化學試卷(解析版) 題型:填空題
為測定硫酸亞鐵銨(NH4)2SO4·FeSO4·6H2O晶體純度,某學生取mg硫酸亞鐵銨樣品配置成500mL溶液,根據物質組成,甲、乙、丙三位同學設計了如下三個實驗方案,請回答:
(甲)方案一:取20.00mL硫酸亞鐵銨溶液于錐形瓶,用0.1000mol·L-1的酸性KMnO4溶液進行滴定。
(乙)方案二:取20.00mL硫酸亞鐵銨溶液進行如下實驗。

(1)方案一的離子方程式為 ;
判斷達到滴定終點的依據是 ;
(2)方案二的離子方程式為 ;若實驗操作都正確,但方案一的測定結果總是小于方案二,其可能原因為 ,如何驗證你的假設 。
(丙)方案三:(通過NH4+測定)實驗設計圖如下所示。取20.00mL硫酸亞鐵銨溶液進行該實驗。
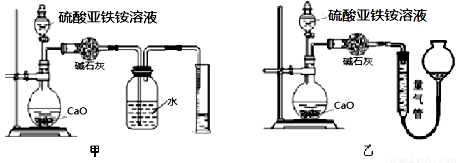
(3)①裝置 (填“甲”或“乙”)較為合理,判斷理由是
。量氣管中最佳試劑是 (填字母編號。如選“乙”則填此空,如選“甲”此空可不填)。
A.水 B.飽和NaHCO3溶液 C.CCl4
②選用該裝置會導致測量值總是偏大一些,分析原因 。
③若測得NH3的體積為VL(已折算為標準狀況下),則該硫酸亞鐵銨晶體的純度為
(列出計算式即可,不用簡化)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com