
| 化學式 | CH3COOH | H2CO3 | HClO |
| 電離平衡常數K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
分析 (1)A.CH3COOH?CH3COO-+H+,加水稀釋導致電離方程式中的三種微粒濃度均減小;
B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$,加水稀釋促進電離,導致n(H+)增大、n(CH3COOH)減小;
C.c(H+)•c(OH-)=Kw,Kw只受溫度的影響;
D.醋酸溶液稀釋過程導致c(H+)減小,Kw不變,由c(H+)•c(OH-)=Kw可知c(OH-)增大;
(2)醋酸是弱電解質,CH3COOH?CH3COO-+H+,加水稀釋促進醋酸電離;向醋酸中加入無水醋酸鈉固體,溶液中醋酸根離子濃度增大,抑制醋酸電離;
(3)氯化氫是強電解質,完全電離,醋酸是弱電解質,溶液中存在電離平衡,加水稀釋促進醋酸電離;
(4)pH相等的醋酸和鹽酸,醋酸的濃度大于鹽酸,等體積、等pH的兩種酸,醋酸的物質的量大于鹽酸,酸的物質的量越多需要等濃度的氫氧化鈉溶液體積越大;
(5)電離平衡常數K越小,說明該酸的酸性越弱,則酸根離子結合H+能力最強;電離常數越大,酸性越強,根據強酸制弱酸原理分析.
解答 解:(1)A.CH3COOH?CH3COO-+H+,加水稀釋導致電離方程式中的三種微粒濃度均減小,因此c(H+)減小,故A正確;
B.加水稀釋促進電離,導致n(H+)增大、n(CH3COOH)減小,因此$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$增大,故B錯誤;
C.c(H+)•c(OH-)=Kw,Kw只受溫度的影響,不受離子濃度變化的影響,因此Kw不變,故C錯誤;
D.醋酸溶液稀釋過程導致c(H+)減小,Kw不變,由c(H+)•c(OH-)=Kw可知c(OH-)增大,因此c(OH-)/c(H+)增大,故D錯誤;
故答案為:A;
(2)醋酸是弱電解質,電離方程式為CH3COOH?CH3COO-+H+,加水稀釋促進醋酸電離,所以醋酸電離平衡向正反應方向移動;向醋酸中加入醋酸鈉固體,溶液中醋酸根離子濃度增大,電離平衡逆向移動,導致c(H+)減小、c(CH3COOH)增大,因此c(H+)/c(CH3COOH)減小,
故答案為:向右;減小;
(3)氯化氫是強電解質,完全電離,稀釋100倍后pH增大2個單位.醋酸是弱電解質,溶液中存在電離平衡,加水稀釋促進醋酸電離,導致醋酸溶液稀釋100倍后pH增大不到2個單位,所以鹽酸的pH大于醋酸,
故答案為:>;
(4)pH相等的醋酸和鹽酸,醋酸的濃度大于鹽酸,等體積、等pH的兩種酸,醋酸的物質的量大于鹽酸,酸的物質的量越多需要等濃度的氫氧化鈉溶液體積越大,所以V(甲)<V(乙),
故答案為:<;
(5)根據表格中K的數值可知H2CO3的K2最小,說明HCO3- 的酸性最弱,因此CO32-結合H+能力最強;
電離常數越大,酸性越強,酸性:CH3COOH>H2CO3>HClO>HCO3-,
CH3COOH和少量Na2CO3溶液反應生成醋酸鈉和二氧化碳,則反應的方程式為:2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑;
HClO和少量的Na2CO3溶液反應生成NaClO和NaHCO3,則反應的方程式為:HClO+CO32-=ClO-+HCO3-;
故答案為:B;2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑;HClO+CO32-=ClO-+HCO3-.
點評 本題考查離子濃度大小比較、酸堿混合的定性判斷、弱電解質的電離等知識,題目難度中等,明確弱電解質和強電解質的電離特點是解題關鍵,注意相同濃度的不同酸稀釋時其pH變化規律,結合電離平衡常數分析解答,試題培養了學生的靈活應用能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題

| A. | 青蒿素屬于無機化合物 | |
| B. | 青蒿素屬于氧化物 | |
| C. | 標準狀況下,1mol青蒿素的體積約為22.4L | |
| D. | 青蒿素的摩爾質量為282g/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

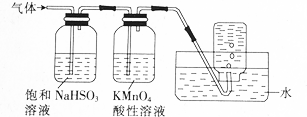
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同主族元素含氧酸的酸性隨核電荷數的增加而減弱 | |
| B. | 核外電子排布相同的微粒化學性質也相同 | |
| C. | 任何元素的原子都是由核外電子和核內中子、質子組成 | |
| D. | ${\;}_{17}^{35}Cl$與${\;}_{17}^{37}Cl$得電子能力相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子核外電子排布式為1s2的元素與原子核外電子排布式為1s22s2的元素化學性質相似 | |
| B. | NaCl的電子式: | |
| C. | F+的結構示意圖: | |
| D. | Fe3+的最外層電子排布式為3s23p63d5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
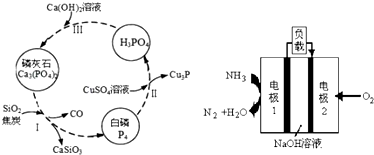
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
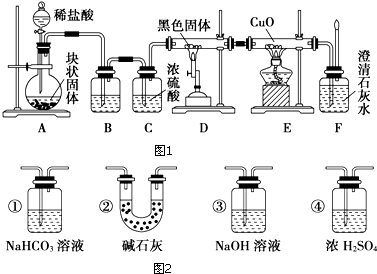
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com