
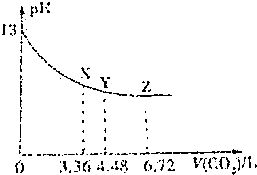
| A. | 該NaOH溶液的濃度為0.1mol/L,體積為6L | |
| B. | X、Y、Z三點對應的溶液中離子的種類不同 | |
| C. | Y點對應的融資中離子濃度關系為:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| D. | Y點對應的溶液中存在著:c(Na+)=2c(HCO3-)+c(OH-) |
分析 氫氧化鈉溶液與二氧化碳反應的方程式為:CO2+2NaOH═Na2CO3+H2O、CO2+NaOH═NaHCO3,通入標況下6.72L二氧化碳后溶液的pH不再變化,說明此時氫氧化鈉與二氧化碳完全反應轉化成碳酸氫鈉,據此可以計算出碳酸氫鈉的物質的量、氫氧化鈉的物質的量,
A.根據二氧化碳體積為0時溶液的pH計算出氫氧化鈉溶液的濃度,再根據氫氧化鈉的物質的量計算出溶液的體積;
B.X、Y、Z三點含有的離子種類相同,都含有:Na+、HCO3-、CO32-、OH-、H+;
C.根據通入標況下體積為4.48L二氧化碳時溶液的溶質判斷各離子濃度大小;
D.根據Y點的物料守恒,結合鹽的水解程度較小進行分析.
解答 解:標準狀況下6.72L二氧化碳的物質的量為:$\frac{6.72L}{22.4L/mol}$=0.3mol,3.36L二氧化碳的物質的量為0.15mol,4.48L二氧化碳的物質的量為0.2mol,
根據圖象可知,當通入0.3mol二氧化碳時,氫氧化鈉與二氧化碳恰好反應生成NaHCO3,根據碳原子守恒,生成碳酸氫鈉的物質的量為0.3mol,
A.根據圖象可知,沒有通入二氧化碳之前,溶液的pH=13,則溶液中氫氧化鈉的濃度為0.1mol/L,由于氫氧化鈉的物質的量為0.3mol,則氫氧化鈉溶液的體積為:$\frac{0.3mol}{0.1mol/L}$=3L,故A錯誤;
B.X、Y、Z三點含有的離子為:Na+、HCO3-、CO32-、OH-、H+,所以含有的離子種類相同,故B錯誤;
C.氫氧化鈉的物質的量為0.3mol,Y點通入0.2mol二氧化碳,0.3mol氫氧化鈉與0.15mol二氧化碳反應生成0.15mol碳酸鈉,剩余的0.05mol二氧化碳與0.05mol碳酸鈉反應生成0.1mol碳酸氫鈉,則Y點溶質為0.1mol碳酸鈉、0.1mol碳酸氫鈉,溶液顯示堿性,則c(OH-)>c(H+),碳酸氫根離子的電離小于碳酸根離子的水解,所以溶液中c(HCO3-)>c(CO32-),溶液中離子濃度大小為:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C正確;
D.根據分析可知,Y點碳酸鈉、碳酸氫鈉的濃度相等,根據物料守恒可得:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),由于水解程度較小,則c(HCO3-)≈c(CO32-),則c(Na+)≈3c(CO32-),所以c(Na+)>2c(HCO3-)+c(OH-),故D錯誤;
故選C.
點評 本題考查了離子反應的計算、鹽的水解原理、離子濃度大小比較等知識,題目難度中等,注意掌握根據離子反應進行計算的方法,能夠根據電荷守恒、鹽的水解原理比較溶液中各離子濃度大小.


科目:高中化學 來源: 題型:解答題
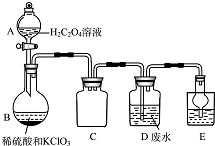 ClO2是一種國際上公認的安全無毒的綠色水處理劑.回答下列問題:
ClO2是一種國際上公認的安全無毒的綠色水處理劑.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 組 別 | 被選出的物質 | 挑選依據 |
| 第(1)組 | ||
| 第(2)組 | ||
| 第(3)組 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 序號 | 甲 | 乙 |
| ① | SO2 | 石灰水 |
| ② | CO2 | 石灰水 |
| ③ | SO2 | Ba(NO3)2 |
| ④ | NO2 | CaCl2 |
| A. | ②③④ | B. | ②③ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤ | B. | ②③⑤ | C. | ②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
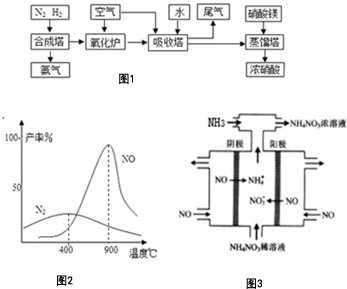 氨、硝酸、硝酸銨、硝酸銅是重要的化工產品.工業合成氨與制備硝酸一般可連續生產,流程如圖1:請回答下列問題
氨、硝酸、硝酸銨、硝酸銅是重要的化工產品.工業合成氨與制備硝酸一般可連續生產,流程如圖1:請回答下列問題查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聯合制堿法中循環使用CO2和NH3,以提高原料利用率 | |
| B. | 硫酸工業中,SO2氧化為SO3時采用常壓,因為高壓會降低SO2轉化率 | |
| C. | 合成氨生產過程中將NH3液化分離,可加快正反應速率,提高N2、H2的轉化率 | |
| D. | 煉鋼是在高溫下利用氧化劑把生鐵中過多的碳和其他雜質氧化成氣體或爐渣除去 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com