
以Na2SO3溶液和不同金屬的硫酸鹽溶液作為實驗對象,探究鹽的性質和鹽溶液間反應的多樣性。
實驗 | 試劑 | 現象 | |
滴管 | 試管 | ||
2 mL | 0.2 mol·L?1 Na2SO3溶液 | 飽和Ag2SO4溶液 | Ⅰ.產生白色沉淀 |
0.2 mol·L?1 CuSO4溶液 | Ⅱ.溶液變綠,繼續滴加產生棕黃色沉淀 | ||
0.1 mol·L?1 Al2(SO4)3溶液 | Ⅲ.開始無明顯變化,繼續滴加產生白色沉淀 | ||
(1)經檢驗,現象Ⅰ中的白色沉淀是Ag2SO3。用離子方程式解釋現象Ⅰ:____________。
(2)經檢驗,現象Ⅱ的棕黃色沉淀中不含SO42?,含有Cu+、Cu2+和SO32?。
已知:Cu+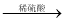 Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+ CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸證實沉淀中含有Cu+的實驗現象是_____________。
②通過下列實驗證實,沉淀中含有Cu2+和SO32?。
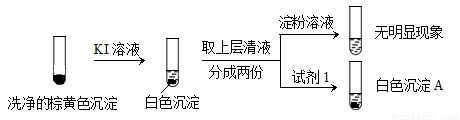
KI溶液 洗凈的棕黃色沉淀 取上層清液 分成兩份 淀粉溶液 試劑1 無明顯現象
白色沉淀A
a.白色沉淀A是BaSO4,試劑1是____________。
b.證實沉淀中含有Cu2+和SO32?的理由是___________。
(3)已知:Al2(SO4)3在水溶液中不存在。經檢驗,現象Ⅲ的白色沉淀中無SO42?,該白色沉淀既能溶于強酸,又能溶于強堿,還可使酸性KMnO4溶液褪色。
①推測沉淀中含有亞硫酸根和________。
②對于沉淀中亞硫酸根的存在形式提出兩種假設:
i.被Al(OH)3所吸附;
ii.存在于鋁的堿式鹽中。
對假設ii設計了對比實驗,證實了假設ii成立。
a.將對比實驗方案補充完整。
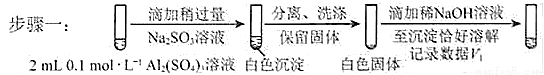
步驟二:_____________(按上圖形式呈現)。
(4)根據實驗,亞硫酸鹽的性質有___________。鹽溶液間反應的多樣性與__________有關。
 新思維假期作業暑假吉林大學出版社系列答案
新思維假期作業暑假吉林大學出版社系列答案 藍天教育暑假優化學習系列答案
藍天教育暑假優化學習系列答案科目:高中化學 來源:2015-2016學年四川省成都市高二下4月月考化學試卷(解析版) 題型:選擇題
如圖為直流電源電解稀Na2SO4水溶液的裝置.通電后在石墨電極a和b附近分別滴加幾滴石蕊溶液.下列實驗現象中正確的是( )
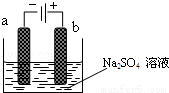
A.逸出氣體的體積,a電極的小于b電極的
B.一電極逸出無味氣體,另一電極逸出刺激性氣味氣體
C.a電極附近呈紅色,b電極附近呈藍色
D.a電極附近呈藍色,b電極附近呈紅色
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西重點中學協作體高二下學期期末化學試卷(解析版) 題型:選擇題
某溫度下,Fe(OH)3(s)、Cu(OH)2(s)分別在溶液中達到沉淀溶解平衡后,改變溶液pH,金屬陽離子濃度的變化如圖所示。據圖分析,下列判斷錯誤的是( )
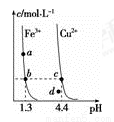
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加適量NH4Cl固體可使溶液由a點變到b點
C.c、d兩點代表的溶液中c(H+)與c(OH-)乘積相等
D.在b、c兩點代表的溶液中Fe(OH)3、Cu(OH)2分別達到飽和
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川省資陽市高二下學期期末化學試卷(解析版) 題型:選擇題
在0.1 mol·L-1NaHCO3與0.1 mol·L-1NaOH等體積混合所得的溶液中,粒子的物質的量濃度關系不正確的是( )
A.c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3)
B.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
C.c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(天津卷精編版) 題型:選擇題
下列選用的儀器和藥品能達到實驗目的的是( )
A | B | C | D |
|
|
|
|
制乙炔的發生裝置 | 蒸餾時的接收裝置 | 除去SO2中的少量HCl | 準確量取一定體積K2Cr2O7標準溶液 |
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(北京卷精編版) 題型:選擇題
在兩份相同的Ba(OH)2溶液中,分別滴入物質的量濃度相等的H2SO4、NaHSO4溶液,其導電能力隨滴入溶液體積變化的曲線如圖所示。
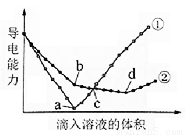
下列分析不正確的是
A.①代表滴加H2SO4溶液的變化曲線
B.b點,溶液中大量存在的離子是Na+、OH–
C.c點,兩溶液中含有相同量的OH–
D.a、d兩點對應的溶液均顯中性
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(新課標3卷精編版) 題型:填空題
[化學——選修3:物質結構與性質]砷化鎵(GaAs)是優良的半導體材料,可用于制作微型激光器或太陽能電池的材料等。回答下列問題:
(1)寫出基態As原子的核外電子排布式________________________。
(2)根據元素周期律,原子半徑Ga_____________As,第一電離能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立體構型為____________________,其中As的雜化軌道類型為_________。
(4)GaF3的熔點高于1000℃,GaCl3的熔點為77.9℃,其原因是_____________________。
(5)GaAs的熔點為1238℃,密度為ρg·cm-3,其晶胞結構如圖所示。該晶體的類型為________________,Ga與As以________鍵鍵合。Ga和As的摩爾質量分別為MGa g·mol-1和MAs g·mol-1,原子半徑分別為rGa pm和rAs pm,阿伏加德羅常數值為NA,則GaAs晶胞中原子的體積占晶胞體積的百分率為____________________。
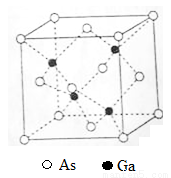
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(新課標2卷精編版) 題型:填空題
聯氨(又稱肼,N2H4,無色液體)是一種應用廣泛的化工原料,可用作火箭燃料,回答下列問題:
(1)聯氨分子的電子式為_____________,其中氮的化合價為____________。
(2)實驗室可用次氯酸鈉溶液與氨反應制備聯氨,反應的化學方程式為___________。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反應熱效應之間的關系式為ΔH4=________________,聯氨和N2O4可作為火箭推進劑的主要原因為_________________________________________________。
(4)聯氨為二元弱堿,在水中的電離方程式與氨相似,聯氨第一步電離反應的平衡常數值為___________________(已知:N2H4+H+ N2H5+的K=8.7×107;KW=1.0×10-14)。聯氨與硫酸形成的酸式鹽的化學式為。
N2H5+的K=8.7×107;KW=1.0×10-14)。聯氨與硫酸形成的酸式鹽的化學式為。
(5)聯氨是一種常用的還原劑。向裝有少量AgBr的試管中加入聯氨溶液,觀察到的現象是___________。聯氨可用于處理高壓鍋爐水中的氧,防止鍋爐被腐蝕。理論上1kg的聯氨可除去水中溶解的O2___________kg;與使用Na2SO3處理水中溶解的O2相比,聯氨的優點是___________。
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(海南卷精編版) 題型:選擇題
下列物質不可用作食品添加劑的是
A.谷氨酸單鈉 B.檸檬酸 C.山梨酸鉀 D.三聚氰胺
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com