
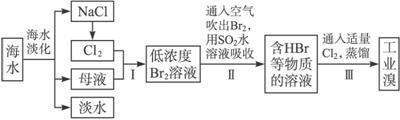
分析 通過海水蒸發得到淡水、NaCl、母液,向母液中通入氯氣,發生反應Cl2+2Br-=2Cl-+Br2,利用熱空氣吹出溴,用SO2吸收Br2,發生反應SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯氣發生反應Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法獲取Br2,
(1)除去海水中的鹽分以獲得淡水的工藝過程叫海水淡化,亦稱海水脫鹽.海水淡化的方法,基本上分為兩大類:從海水中取淡水,有蒸留法、反滲透法、水合物法、溶劑萃取法和冰凍法;除去海水中的鹽分,有電滲拆法、離子交換法和壓滲法;
(2)海水淡化得到的母液和電解氯化鈉溶液生成的氯氣反應,得到的溴單質濃度低,溴單質在水中有一定的溶解性且和水反應,提取時消耗過的能源和原料,降低了經濟效益;
(3)SO2吸收溴,依據氧化還原反應生成物書寫基本規律,Br元素在自然中-1價穩定.由于此反應有強酸HBr和H2SO4生成,易腐蝕設備,據此寫出工業生產需要解決的問題;
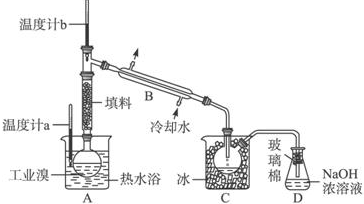
(4)工業制溴中提純溴的方法,主要是利用蒸餾方法,由于Br2具有強氧化性,易把橡膠塞和橡膠管氧化腐蝕,所以不用橡膠塞和橡膠管;由于題干中給出信息Br2的沸點是59℃,提純溴必須收集59℃時的餾分,所以控制溫度得到餾分是關鍵;C中液體為冷凝下來的純溴,則顏色為深棕紅色,除去該產物中仍殘留的少量Cl2,加入NaBr溶液,和氯氣反應生成氯化鈉和溴單質,達到除去氯氣的目的,充分反應后,用蒸餾的方法得到.
解答 解:通過海水蒸發得到淡水、NaCl、母液,向母液中通入氯氣,發生反應Cl2+2Br-=2Cl-+Br2,利用熱空氣吹出溴,用SO2吸收Br2,發生反應SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯氣發生反應Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法獲取Br2,
(1)海水淡化的有蒸餾法、電滲析法、離子交換法等,故答案為:蒸餾法;電滲析法;
(2)海水中溴元素含量較少,步驟I中已獲得Br2,步驟Ⅱ中又將Br2還原為Br-,其目的為富集溴元素,
故答案為:富集溴元素;
(3)在水溶液里溴和二氧化硫反應離子方程式為SO2+Br2+2H2O=4H++SO42-+2Br-,由此反應可知,生成物為強酸,所以除環境保護外,在工業生產中應解決的主要問題是強酸對設備的嚴重腐蝕,
故答案為:SO2+Br2+2H2O=4H++SO42-+2Br-;強酸對設備的嚴重腐蝕;
(4)①圖中儀器B的名稱是冷凝管,故答案為:冷凝管;
②溴能腐蝕橡膠,所以整套實驗裝置中儀器連接均不能用橡膠塞和橡膠管,故答案為:溴腐蝕橡膠;
③實驗裝置氣密性良好,要達到提純溴的目的,操作中如何控制關鍵條件:控制溫度計b的溫度,并收集59℃的餾分,溫度過高或過低都不利于溴的收集,
故答案為:控制溫度計b的溫度,并收集59℃的餾分;
④C中液體產物為溴,顏色為深紅棕色,為除去該產物中仍殘留的少量C12,可向其中加入NaBr溶液,充分反應后,再進行分離的操作是分液,故答案為:深紅棕色;分液.
點評 本題考查物質的分離、提純的綜合涉及,側重考查海水資源的綜合利用,為高考常見題型和高頻考點,題目難度中等,注意從整體上把握溴的提純過程,知道提純過程中發生的反應及基本操作方法,再結合物質的性質分析解答.


科目:高中化學 來源: 題型:選擇題
| A. | 比賽時,籃球內一般充填氮氣 | B. | 比賽時,籃球內約有空氣0.3mol | ||
| C. | 比賽時,籃球內約有空氣14.8g | D. | 當25℃,170kPa時,Vm>24.5L/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲燒杯中放入鋅的質量比乙燒杯中放入鋅的質量大 | |
| B. | 甲燒杯中的酸過量 | |
| C. | 甲燒杯比乙燒杯反應快 | |
| D. | 反應開始后乙燒杯中的c(H+)始終比甲燒杯中的c(H+)小 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某研究性學習小組設計了一組實驗驗證元素周期律.
某研究性學習小組設計了一組實驗驗證元素周期律.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 滴加酚酞的氨水中加入氯化銨固體后紅色變淺 | |
| B. | 棕紅色的NO2加壓后顏色先變深后變淺(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工業上生產硫酸的過程中,使用過量的空氣以提高SO2的利用率 | |
| D. | 用硫酸氫鈉去除暖水瓶中的水垢 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com