
 Ⅰ.Li-Al/FeS電池是一種正在開發的車載電池,該電池中正極的電極反應式為2Li++FeS+2e-═Li2S+Fe,則該電池的總反應式為2Li+FeS═Li2S+Fe.
Ⅰ.Li-Al/FeS電池是一種正在開發的車載電池,該電池中正極的電極反應式為2Li++FeS+2e-═Li2S+Fe,則該電池的總反應式為2Li+FeS═Li2S+Fe.分析 Ⅰ.Li-Al/FeS電池是一種二次電池,原電池工作時,較為活潑的單質鋰作負極,正負極反應相加可得反應的電池總反應;
Ⅱ.(1)根據Ksp的意義,越是Ksp小的物質越容易生成,注意不能引進雜質離子,據此回答;
(2)A.同素異形體是同種元素組成的單質;
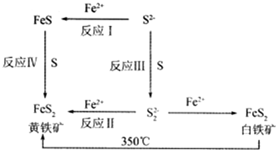
B.黃鐵礦和白鐵礦的分子式是一樣的性質有差別;
C.黃鐵礦是白鐵礦加熱下的產物.
(3)S22-在酸性環境下可以發生自身氧化還原反應;
(4)①金屬鋰可以和水之間反應生成氫氧化鋰和氫氣;
②根據信息:第一次放電行為的反應是溫度低時,鋰與FeS2反應只生成A物質;第二次放電行為的反應是:溫度升高,鋰與A繼續反應(產物之一為Fe),據此回答;
(5)FeS為陽極,Al為陰極,陽極上會發生失電子的氧化反應,據此書寫電極反應.
解答 解:Ⅰ.該電池中正極的電極反應式為:2Li++FeS+2e-═Li2S+Fe;負極的電極反應式為:Li-e-═Li+.正負極反應相加可得反應的電池總反應為2Li+FeS═Li2S+Fe,故答案為:2Li+FeS═Li2S+Fe;
Ⅱ.(1)越是Ksp小的物質越容易生成,CuS、H2S都和氯化亞鐵之間不反應,硫化銨可以和氯化亞鐵之間反應得到硫化亞鐵沉淀,但是硫化鈉的溶液堿性較強,不可避免的會產生氫氧化亞鐵雜質,所以A更適宜.
故選A;
(2)A.同素異形體是同種元素組成的單質,但是黃鐵礦和白鐵礦是化合物,故A錯誤;
B.黃鐵礦和白鐵礦的分子式是一樣的,因為晶體結構不同而導致性質有差別,故B正確;
C.黃鐵礦是白鐵礦加熱下的產物,由此可見黃鐵礦比白鐵礦更穩定,故C正確;
故選A;
(3)S22-在酸性環境下可以發生自身氧化還原反應,即S22-+2H+=S↓+H2S↑,故答案為:S22-+2H+=S↓+H2S↑;
(4)①金屬鋰可以和水之間反應生成氫氧化鋰和氫氣;
②根據信息:第一次放電行為的反應是溫度低時,鋰與FeS2反應只生成A物質,即2Li+FeS2=Li2FeS2,第二次放電行為的反應是:溫度升高,鋰與A繼續反應(產物之一為Fe),發生的反應為:2Li+Li2FeS2=2Li2S+Fe,故答案為:2Li+FeS2=Li2FeS2;2Li+Li2FeS2=2Li2S+Fe;
(5)FeS為陽極,Al為陰極,陽極上會發生失電子的氧化反應,發生的電極反應為:2FeS-2e-=FeS2+Fe2+,故答案為:2FeS-2e-=FeS2+Fe2+.
點評 本題綜合考查學生元素以及化合物的性質、電化學反應原理等基本知識,屬于綜合知識的考查,難度中等.


科目:高中化學 來源: 題型:選擇題
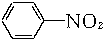 +3Fe+6HCl→
+3Fe+6HCl→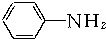 +3FeCl3+2H2O
+3FeCl3+2H2O +3H2$→_{△}^{催化劑}$
+3H2$→_{△}^{催化劑}$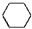
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
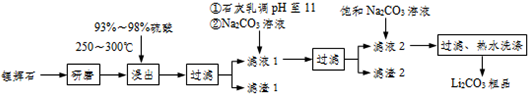
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
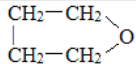 .
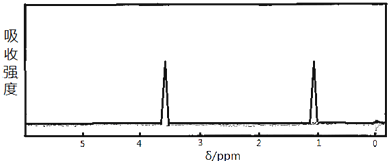
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | b L | B. | (b-a)L | C. | (2a-b)L | D. | (2b-a)L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
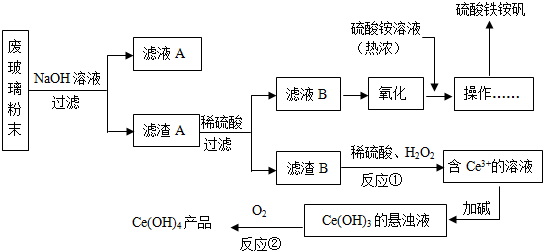
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  點燃酒精燈 | |
| B. | 不慎將濃堿溶液沾到皮膚上,要立即用大量水沖洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 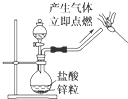 制備氫氣并檢驗H2的可燃性 | |
| D. | 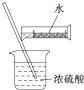 配制硫酸溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 難溶電解質 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com