
高錳酸鉀是中學化學常用的強氧化劑,實驗室中可通過以下反應制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相關物質的溶解度數據見下表:
20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
已知K2MnO4溶液顯綠色,KMnO4溶液紫紅色。
實驗流程如下:
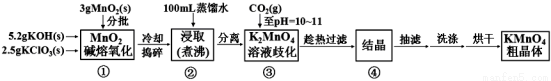
請回答:
(1)步驟①應在 中熔化,并用鐵棒用力攪拌,以防結塊。
A.燒杯 B.蒸發皿 C.瓷坩堝 D.鐵坩堝
(2)①綜合相關物質的化學性質及溶解度,步驟③中可以替代CO2的試劑是 。
A.二氧化硫 B.稀醋酸 C.稀鹽酸 D.稀硫酸
②當溶液pH值達10~11時,停止通CO2;若CO2過多,造成的后果是 。
③下列監控K2MnO4歧化完全的方法或操作可行的是 。
A.通過觀察溶液顏色變化,若溶液顏色由綠色完全變成紫紅色,表明反應已歧化完全
B.取上層清液少許于試管中,繼續通入CO2,若無沉淀產生,表明反應已歧化完全
C.用玻璃棒蘸取溶液點在濾紙上,若濾紙上只有紫紅色痕跡,無綠色痕跡,表明反應已歧化完全
D.用pH試紙測定溶液的pH值,對照標準比色卡,若pH為10~11,表明反應已歧化完全
(3)步驟④的操作是把濾液移至蒸發皿內,用小火加熱,當濃縮至 (填實驗現象)時,停止加熱,冷卻,即有KMnO4晶體析出。
(4)烘干時,溫度控制在80℃為宜,理由是 。
(5)通過用草酸滴定KMnO4溶液的方法可測定KMnO4粗品的純度(質量分數)。
①實驗時先將草酸晶體(H2C2O4·2H2O)配成標準溶液,實驗室常用的容量瓶的規格有100mL、250mL等多種,現配制90mL 1.5mol·L-1的草酸溶液,需要稱取草酸晶體的質量為 g。[已知Mr(H2C2O4·2H2O)=126]
②量取KMnO4溶液應選用 (填“酸式”或“堿式”)滴定管,若該滴定管用蒸餾水洗凈后未潤洗,則最終測定結果將 (填“偏大”、“偏小”或“不變”)。
科目:高中化學 來源:2015-2016學年廣西欽州港經濟開發區中學高二上12月月考化學試卷(解析版) 題型:選擇題
飄塵是物質燃燒時產生的粉狀飄浮物,顆粒很小,不易沉降。它與空氣中的SO 2 、O 2 接觸時,SO 2 會部分轉化為SO3,使空氣中的酸度增加。飄塵所起的作用可能是
A.氧化劑 B.還原劑 C.催化劑 D.吸附劑
查看答案和解析>>
科目:高中化學 來源:2016屆福建省閩粵聯合體高三上學期第三次聯考化學試卷(解析版) 題型:選擇題
某物質可由兩種單質直接化合生成,將其加入Ba(HCO3)2溶液中同時有氣體和沉淀產生。下列物質中不符合上述條件的是
A.AlCl3 B.Na2O2 C.FeCl2 D.Al2S3
查看答案和解析>>
科目:高中化學 來源:2016屆福建省高三上12月月考化學試卷(解析版) 題型:填空題
一種含鋁、鋰、鈷的新型電子材料,生產中產生的廢料數量可觀,廢料中的鋁以金屬鋁箔的形式存在;鈷以Co2O3·CoO的形式存在,吸附在鋁箔的單面或雙面;鋰混雜于其中。從廢料中回收氧化鈷(CoO)的工藝流程如圖所示:
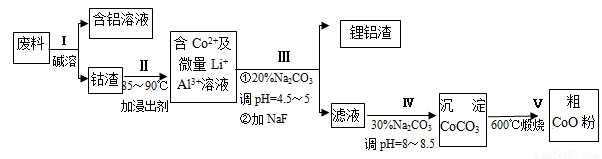
(1)過程I中采用NaOH溶液溶出廢料中的Al,反應的離子方程式為 。
(2)過程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出鈷。則浸出鈷的化學反應方程式為(產物中只有一種酸根) 。在實驗室模擬工業生產時,也可用鹽酸浸出鈷,但實際工業生產中不用鹽酸,請從反應原理分析不用鹽酸浸出鈷的主要原因 。
(3)過程Ⅲ得到鋰鋁渣的主要成分是LiF和Al(OH)3,碳酸鈉溶液在產生Al(OH)3時起重要作用,請寫出該反應的離子方程式 。
(4)碳酸鈉溶液在過程Ⅲ和Ⅳ中所起作用有所不同,請寫出在過程IV中起的作用是_____________。
(5)在Na2CO3溶液中存在多種粒子,下列各粒子濃度關系正確的是____________(填序號)。
A.c(Na+) = 2c(CO32-) B.c(Na+) > c(CO32-) > c(HCO3-)
C.c(OH-) > c(HCO3-) > c(H+) D.c(OH-)-c(H+) = c(HCO3-) + 2c(H2CO3)
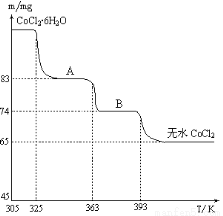
(6)CoO溶于鹽酸可得粉紅色的CoCl2溶液。CoCl2含結晶水數目不同而呈現不同顏色,利用藍色的無水CoCl2吸水變色這一性質可制成變色水泥和顯隱墨水。下圖是粉紅色的CoCl2·6H2O晶體受熱分解時,剩余固體質量隨溫度變化的曲線,A物質的化學式是____________。
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省高三上期末熱身理綜化學試卷(解析版) 題型:填空題
堿式碳酸鈷[ Cox(OH)y(CO3)z ]常用作電子材料,磁性材料的添加劑,受熱時可分解生成三種氧化物。為了確定其組成,某化學興趣小組同學設計了如圖所示裝置進行實驗。

(1)請完成下列實驗步驟:
①稱取3.65g樣品置于硬質玻璃管內,稱量乙、丙裝置的質量;
②按如圖所示裝置組裝好儀器,并檢驗裝置氣密性;
③加熱甲中玻璃管,當乙裝置中____________(填實驗現象),停止加熱;
④打開活塞a,緩緩通入空氣數分鐘后,稱量乙、丙裝置的質量;
⑤計算。
(2)步驟④中緩緩通入空氣數分鐘的目的是_____________________
(3)某同學認為上述實驗裝置中存在一個明顯缺陷,為解決這一問題,可選用下列裝置中的______(填字母)連接在_________(填裝置連接位置)。

(4)若按正確裝置進行實驗,測得如下數據:
乙裝置的質量/g | 丙裝置的質量/g | |
加熱前 | 80.00 | 62.00 |
加熱后 | 80.36 | 62.88 |
則該堿式碳酸鈷的化學式為_________________。
(5)含有Co(AlO2)2的玻璃常用作實驗室觀察鉀元素的焰色反應,該玻璃的顏色為___________。
(6)CoCl2·6H2O常用作多彩水泥的添加劑,以含鈷廢料(含少量Fe、Al等雜質)制取CoCl2·6H2O的一種工藝如下:

已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)2 |
開始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
①凈除雜質時,加入H2O2 發生反應的離子方程式為______________。
②加入CoCO3調PH為5.2~7.6,則操作Ⅰ獲得的濾渣成分為_____________。
③加鹽酸調整PH為2~3的目的為__________________________________。
④操作Ⅱ過程為___________(填操作名稱)、過濾。
查看答案和解析>>
科目:高中化學 來源:2016屆浙江省金麗衢十二校高三上學期第一次聯考化學試卷(解析版) 題型:選擇題
實驗室從含Br-的廢液中提取溴單質,下列說法中能達到實驗目的的是
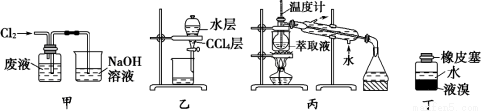
A.用裝置甲氧化廢液中的Br-
B.用裝置乙分離CCl4層和水層
C.用裝置丙分離CCl4和液溴
D.用儀器丁長期貯存液溴
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省高一上第二次月考化學試卷(解析版) 題型:選擇題
50g鎂、鋅、鋁的混合物與適量的稀硫酸反應,得三種鹽的混合溶液,然后加熱、蒸發、結晶得晶體(不含結晶水)218g,則反應中得到H2的質量為
A.2g B.3g C.3.5g D.4.5g
查看答案和解析>>
科目:高中化學 來源:2015-2016學年福建省高一上第二次月考化學試卷(解析版) 題型:選擇題
在體積為V L的密閉容器中,通入a mol NO和b mol O2,反應后容器內氮原子和氧原子數之比為
A.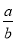 B.
B.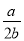 C.
C.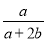 D.
D.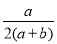
查看答案和解析>>
科目:高中化學 來源:2015-2016學年內蒙古高二普通班上期中化學試卷(解析版) 題型:選擇題
25℃時有關物質的顏色和溶度積(Ksp)如表:下列敘述中不正確的是( )
物質 | AgCl | AgBr | AgI | Ag2S |
顏色 | 白 | 淡黃 | 黃 | 黑 |
Ksp | 1.8×10﹣10 | 7.7×10﹣13 | 1.5×10﹣16 | 1.8×10﹣50 |
A.向AgCl的白色懸濁液中加入0.1 mol•L﹣1KI溶液,有黃色沉淀產生
B.25℃時,AgCl、AgBr、AgI、Ag2S飽和水溶液中Ag+的濃度相同
C.25℃,AgCl固體在等物質的量濃度NaCl、CaCl2溶液中的溶度積相同
D.在5 mL 1.8×10﹣6mol•L﹣1NaCl溶液中,加入1滴(20滴約為1 mL)1×10﹣3mol•L﹣1AgNO3溶液,不能產生白色沉淀
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com