
分析 (1)所給的物質組合中,HNO3中氮元素化合價位于最高價,具有氧化性,對應還原產物為N2O,硫酸亞鐵中二價鐵離子被氧化生成三價鐵離子,為還原劑,對應氧化產物為硫酸鐵和硝酸鐵,根據氫原子守恒,水在生成物中,根據化合價升降相等和原子守恒配平后發生的反應,據此解答;
(2)反應物中所含元素化合價升高的物質被氧化;所含元素化合價降低的被還原;
(3)根據化合價變化數目計算1mol氧化劑發生還原時轉移電子數.
解答 解:所給的物質組合中,HNO3中氮元素化合價位于最高價,具有氧化性,對應還原產物為N2O,硫酸亞鐵中二價鐵離子被氧化生成三價鐵離子,為還原劑,對應氧化產物為硫酸鐵和硝酸鐵,依據原子個數守恒、得失電子守恒可知,該反應的化學方程式:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,
故答案為:30HNO3;24FeSO4;8Fe(NO3)3;8Fe2(SO4)3;3N2O;15H2O;
(2)依據方程式:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,可知:硫酸亞鐵中的二價鐵離子化合價升高,所以硫酸亞鐵被氧化;
硝酸中N元素化合價,被還原;
故答案為:FeSO4;N;
(3)30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,硝酸為氧化劑,由方程式可知:
HNO3~0.5N2O~轉移電子數4,
1mol 4mol;
故答案為:4.
點評 本題考查了化學方程式書寫,側重考查氧化還原方程式的書寫,依據物質的性質及氧化還原反應的強弱規律判斷反應物與生成為解題關鍵,注意對基本概念的掌握.


科目:高中化學 來源: 題型:選擇題
| A. | 32g S2-中電子數目為2NA | |
| B. | 46g NO2和N2O4的混合物中含有的原子數為3NA | |
| C. | 1L 0.5mol•L-1 Na2CO3溶液中含有的CO32-數為0.5NA | |
| D. | 78g Na2O2中陰離子數目為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應后溶液中不存在任何沉淀,所以反應前后Cu2+的濃度不變 | |
| B. | 在[Cu(NH3)4]2+離子中,Cu2+提供空軌道,NH3提供孤對電子 | |
| C. | 沉淀溶解后將生成深藍色的正四面體形的配離子[Cu(NH3)4]2+ | |
| D. | 加入極性較小的溶劑乙醇后,將析出[Cu(H2O)4]SO4•H2O晶體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2、SO3都是極性分子 | |
| B. | 在H3O+和[Cu(H2O)4]2+中都存在配位鍵 | |
| C. | 元素電負性越大的原子,該元素的原子吸引鍵合電子的能力越強 | |
| D. | 原子晶體中原子以共價鍵結合,具有鍵能大、熔點高、硬度大的特性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學鍵是一種作用力 | |
| B. | 化學鍵可以使離子相結合,也可以使原子相結合 | |
| C. | 一種物質只含兩種非金屬元素,該物質中一定沒有非極性供價鍵 | |
| D. | 氫鍵屬于分子間作用力,不屬于化學鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用水不能鑒別苯和溴苯 | |
| B. | 苯不能使KMnO4溶液褪色,因此苯不能發生氧化反應 | |
| C. | 乙烯、氯乙烯、聚乙烯均可使酸性高錳鉀溶液褪色 | |
| D. | 某有機物的分子結構如圖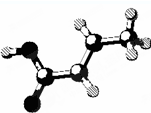 (圖中棍表示單鍵、雙鍵或叁鍵),它屬于烴的含氧衍生物,該有機物可發生取代反應和加成反應 (圖中棍表示單鍵、雙鍵或叁鍵),它屬于烴的含氧衍生物,該有機物可發生取代反應和加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制備Fe(OH)3膠體時,應往沸水中逐滴加lmol•L-l的FeCl3溶液,并繼續加熱到液體呈透明的紅褐色為止 | |
| B. | 加熱NH4Cl晶體時,用濕潤的紅色石蕊試紙靠近試管口,檢驗NH3的生成 | |
| C. | 將金屬鈉在研缽中研成粉末,使鈉與水反應的實驗更安全 | |
| D. | 用托盤天平準確稱取5.85g NaCl固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,4.6 g NO2氣體約含有1.81×1023個原子 | |
| B. | 在標準狀況下,80 gSO3所占的體積約為22.4L | |
| C. | 常溫下,0.1 mol/L醋酸溶液的pH約為1 | |
| D. | 標準狀況下,22.4L氯氣與足量氫氧化鈉溶液反應,轉移的電子數為2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com