
【題目】某溫度時在2L容器中X、Y、Z三種物質的物質的量(n)隨時間(t)變化的曲線如圖所示,由圖中數據
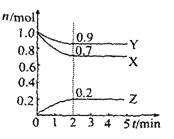
(1)該反應的化學方程式為:_____
(2)反應開始至2min,用Z表示的平均反應速率為:____
(3)下列敘述能說明上述反應達到化學平衡狀態的是____(填序號)
A.混合氣體的總物質的量不隨時間的變化而變化
B.混合氣體的壓強不隨時間的變化而變化
C.單位時間內每消耗3mol X,同時生成2mol Z
D.混合氣體的總質量不隨時間的變化而變化
(4)在密閉容器里,通入a mol X(g)和b mol Y(g),發生反應X(g) + Y(g) = 2Z(g),當改變下列條件時,反應速率會發生什么變化(選填“增大”、“減小”或“不變”)?
①降低溫度:____
②加入催化劑:____
③增大容器的體積:____
【答案】3X + Y![]() 2Z 0.05 mol·L-1·min-1 AB 減小 增大 減小
2Z 0.05 mol·L-1·min-1 AB 減小 增大 減小
【解析】
利用坐標圖象推斷X、Y、Z發生反應的化學方程式時,首先從圖象的起點切入,依據物質的量的變化趨勢確定反應物和生成物,其次利用各物質的物質的量的變化量,確定化學計量數,最后依據反應結束后是否存在某一物質的量為0,確定反應是可逆反應還是不可逆反應。利用某量判斷平衡狀態時,需分析題中所給的量是常量還是變量,變量不變是平衡狀態;分析條件改變對反應速率的影響時,需分析條件改變后,能否引起分子碰撞次數的增大或活化能的降低。
(1)從反應起點看,X 、 Y為反應物,Z為生成物;從變化量之比等于化學計量數之比分析,化學計量數為3X+ Y→2Z;從反應的最終結果看,沒有一種物質的物質的量為0,所以反應可逆,因此該反應的化學方程式為:3X + Y![]() 2Z。答案為:3X + Y
2Z。答案為:3X + Y![]() 2Z;
2Z;
(2)反應開始至2min,用Z表示的平均反應速率為: =0.05 mol·L-1·min-1。答案為:0.05 mol·L-1·min-1;
=0.05 mol·L-1·min-1。答案為:0.05 mol·L-1·min-1;
(3)A.隨著反應的進行,混合氣體的總物質的量減小,當物質的量不變時,反應達平衡狀態,A符合題意;
B.隨著反應的進行,氣體的總物質的量不斷減小,混合氣體的壓強不斷減小,當混合氣體的壓強不變時,氣體的物質的量不變,反應達平衡狀態,B符合題意;
C.不管反應是否達平衡,單位時間內每消耗3mol X,同時生成2mol Z,此時反應不一定達平衡狀態,C不合題意;
D.不管反應進行到什么程度,混合氣體的總質量都保持不變,所以混合氣體總質量不變時,不一定達平衡狀態,D不合題意;
故選AB。答案為:AB;
(4) ①降低溫度:反應物的能量降低,有效碰撞次數減少,反應速率減小;
②加入催化劑:降低反應的活化能,增大活化分子百分數,化學反應速率加快;
③增大容器的體積:減小反應混合物的濃度,分子有效碰撞的次數減少,反應速率減慢;
答案為:減小;增大;減小。


 王后雄學案教材完全解讀系列答案
王后雄學案教材完全解讀系列答案 海淀課時新作業金榜卷系列答案
海淀課時新作業金榜卷系列答案科目:高中化學 來源: 題型:
【題目】原電池原理的發現是儲能和供能技術的巨大進步,是化學對人類的一項重大貢獻。將純鋅片和純銅片按圖方式插入100 mL相同濃度的稀硫酸中一段時間,回答下列問題:
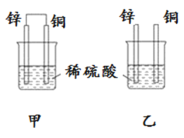
(1)下列說法正確的是____________。
A.甲、乙均為化學能轉變為電能的裝置 B.乙中銅片上沒有明顯變化
C.甲中銅片質量減少、乙中鋅片質量減少 D.甲乙兩燒杯中溶液的 pH 均增大
(2)同條件下兩燒杯中產生同體積的氣體,需要的時間甲________乙(填“>”“<”或“=”)。
(3)請寫出甲乙圖中構成原電池的負極電極反應式:__________________。
(4)當甲中溶液質量增重15.75g時,電極上轉移電子數目為______________。
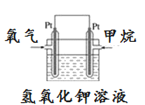
(5)如圖為甲烷氧氣燃料電池的構造示意圖,電解質溶液的溶質是KOH。寫出正極的電極反應方程式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,不屬于取代反應的是
A. ![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
B. CH2=CH2+Br2 ![]() BrCH2CH2Br
BrCH2CH2Br
C. CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
D. CH3CH2CH2Br+NaOH![]() CH3CH2CH2OH+NaBr
CH3CH2CH2OH+NaBr
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】具有抗菌作用的白頭翁素衍生物I的合成路線如圖所示:

已知:
ⅰ.R-HC=CH-R’+R”COOH![]()
ⅱ.R-HC=CH-R”![]() (以上R、R’、R”代表氫、烷基或芳基等)。
(以上R、R’、R”代表氫、烷基或芳基等)。
回答下列問題:
(1)反應①的反應類型是___。
(2)寫出反應②的化學方程式是___。
(3)合成過程中設計步驟①和④的目的是___。
(4)試劑a是___。
(5)下列說法正確的是___(選填字母序號)。
a.物質A極易溶于水 b.③反應后的試管可以用硝酸洗滌
c.F生成G的反應類型是取代反應 d.物質D既能與鹽酸反應又能與氫氧化鈉鈉溶液反應
(6)由F與I2在一定條件下反應生成G的化學方程式是___;此反應同時生成另外一個有機副產物且與G互為同分異構體,此有機副產物的結構簡式是___。
(7)已知:RCH2Br![]() R-CH=CH-R1
R-CH=CH-R1
以乙烯起始原料,結合已知信息選用必要的無機試劑合成 ,寫出合成路線(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)___。
,寫出合成路線(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:A是來自石油的重要有機化工原料,此物質可以用來衡量一個國家石油化工發展水平.E是具有果香味的有機物,F是一種高聚物,可制成多種包裝材料.
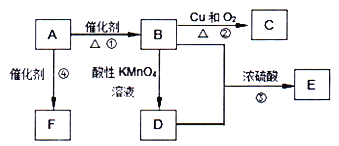
(1)A的結構式為________,C的名稱為________。
(2)B分子中的官能團名稱是________,請設計一種驗證B物質存在該官能團的方法________。
(3)寫出下列反應的化學方程式并指出反應類型:
①________;反應類型是________;
④________;反應類型是________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于烴的說法正確的是

A. 該烴分子中共面的碳原子最多為14個
B. 該烴分子中共直線的碳原子只有為4個
C. 該烴存在順反異構
D. 1mol 該烴與溴水反應時最多可以消耗6molBr2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】七水硫酸鎂(MgSO4·7H2O)在印染、造紙和醫藥等工業上有重要的用途。硼鎂泥是硼鎂礦生產硼砂的廢渣,其主要成分是MgCO3,還含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等雜質,工業上用硼鎂泥制取七水硫酸鎂的工藝流程如圖:
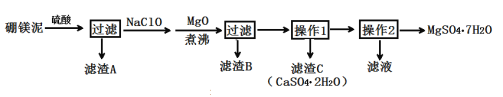
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同溫度下的溶解度(g)數據如下表所示:
溫度/℃ 物質 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)開始用到硫酸的質量分數為70%,密度為1.61g/cm3,則該硫酸溶液的物質的量濃度為___。
(2)濾渣A中除含少量CaSO4·2H2O外,還有___。
(3)加入MgO后,加熱煮沸的目的是___。
(4)若濾渣B的主要成分為Al(OH)3和Fe(OH)3。則加入NaClO發生氧化還原反應的離子方程式為___。
(5)流程中操作1為蒸發濃縮、趁熱過濾,這樣即可得到CaSO4·2H2O,又防止___。
(6)獲取MgSO4·7H2O的操作2為:___、___、過濾洗滌。
(7)已知開始硼鎂泥樣品的質量為ag,制取七水硫酸鎂的質量為bg,據此能計算出硼鎂泥中鎂元素的含量嗎?若能,請寫出表達式;若不能,請說明理由。___(能或不能),表達式(或理由)為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)現有下列幾種有機物:①乙炔、②乙醇、③乙醛、④乙酸、⑤甲酸乙酯、⑥苯酚、⑦溴乙烷。其中: 能與 Na2CO3 溶液反應產生氣泡的是___(填序號,下同);遇氯化鐵溶液呈紫色的是________;能發生銀鏡反應的是_____;不能使酸性 KMnO4 溶液褪色的是______。
(2)按要求寫出下列反應方程式
①實驗室制取乙炔:____________
②實驗室制取乙烯:________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用乙醇制取乙烯的裝置如下圖,回答下列問題。
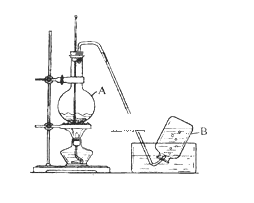
(1)儀器A的名稱是__________ ;A中加入沸石的目的是 __________;在燒杯中配制A中溶液的方法是__________ ;在反應中濃硫酸的作用是__________;A中發生反應的化學方程式是 __________ 。
(2)A中產生的氣體除乙烯外,還可能混有少量 __________(填化學式)
(3)用乙烯制聚乙烯的化學方程式為 __________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com