
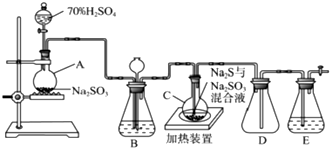
分析 A中的亞硫酸鈉中加入濃硫酸生成二氧化硫,裝置B的作用之一是觀察SO2的生成速率,為提高產品純度,應使燒瓶C中Na2S和Na2SO3恰好完全反應,燒瓶C中發生反應如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq) (Ⅲ)
反應終止后,燒瓶C中的溶液經蒸發濃縮、冷卻結晶即可析出Na2S2O3•5H2O,E中盛放NaOH溶液進行尾氣處理,防止含硫化合物排放在環境中,
(1)利用液面差在一段時間不變檢驗氣密性,D可防止液體倒吸,E中盛放NaOH溶液進行尾氣處理;
(2)C中Na2S和Na2SO3恰好完全反應,結合燒杯C中的反應分析;
(3)觀察SO2的生成速率,發生強酸制取弱酸的反應,為使SO2緩慢進入燒瓶C,應控制B中硫酸的加入速度,Ⅲ中發生S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq),反應達到終點是S完全溶解,燒杯、錐形瓶需要加熱時必須使用石棉網,蒸發皿、試管可直接加熱;
(4)檢測產品中是否存在Na2SO4,先加鹽酸排除干擾,再利用氯化鋇檢驗硫酸根離子.
解答 解:(1)儀器組裝完成后,關閉兩端活塞,向裝置B中的長頸漏斗內注入液體至形成一段液柱,若液柱高度保持不變,則氣密性良好,D中左側為短導管可防止液體倒吸,E中盛放NaOH溶液進行尾氣處理,防止含硫化合物排放在環境中,
故答案為:液柱高度保持不變;防止倒吸;NaOH;
(2)C中Na2S和Na2SO3恰好完全反應,由Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l)(Ⅱ)
S(g)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq)(Ⅲ)
可知,(Ⅰ)×2+(Ⅱ)+(Ⅲ)×3,得到總反應為2Na2S(aq)+Na2SO3(aq)+3SO2(g)$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S2O3(aq),則C中Na2S和Na2SO3物質的量之比為2:1,
故答案為:2:1;
(3)觀察SO2的生成速率,發生強酸制取弱酸的反應,a不生成二氧化硫,bd中物質均與二氧化硫反應,只有c中飽和NaHSO3溶液適合制取二氧化硫;為使SO2緩慢進入燒瓶C,應控制B中滴加硫酸的速度,Ⅲ中發生S(g)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq),反應達到終點是S完全溶解,可觀察到溶液變澄清(或渾濁消失);燒杯、錐形瓶需要加熱時必須使用石棉網,
故答案為:c;控制滴加硫酸的速度;溶液變澄清(或渾濁消失);ad;
(4)檢測產品中是否存在Na2SO4,操作、現象和結論為取少量產品溶于足量稀鹽酸中,靜置,取上層清液(或過濾后取濾液),滴加BaCl2溶液,若出現白色沉淀則說明含有Na2SO4雜質,
故答案為:取少量產品溶于足量稀鹽酸中,靜置,取上層清液(或過濾后取濾液),滴加BaCl2溶液,若出現白色沉淀則說明含有Na2SO4雜質.
點評 本題主要考查氣密性檢驗、氧化還原反應及離子檢驗等,側重實驗分析能力及知識綜合應用能力的考查,題目難度中等,注意(2)中發生的反應及總反應的分析為易錯點.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 12g石墨和C60的混合固體中,含NA個碳原子 | |
| B. | 標準狀況下,2.24L水中含有0.1NA個水分子 | |
| C. | 7.8g過氧化鈉含有的陰離子數為0.2NA | |
| D. | 0.1mol鐵在足量氯氣中燃燒,電子轉移數目為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示可逆反應的進行程度越大,K值大小與溫度的關系是:溫度升高,K值可能增大也可能減小.(填一定增大、一定減小、或可能增大也可能減小);
(1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示可逆反應的進行程度越大,K值大小與溫度的關系是:溫度升高,K值可能增大也可能減小.(填一定增大、一定減小、或可能增大也可能減小);查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素編號 | 元素性質或原子結構 |
| T | M層上有2對成對電子 |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 常溫下單質為雙原子分子,其氫化物水溶液呈堿性 |
| Z | 元素最高正價是+7價 |
 (用元素符號表示)
(用元素符號表示)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 大霧是一種純凈物 | |
| B. | 大霧是一種分散質微粒直徑大于100 nm 的分散系 | |
| C. | 光束通過大霧時會產生一條光亮的通路 | |
| D. | 大霧實際上是水蒸氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com