
 已知A、B、R、D都是周期表中前四周期的元素,它們的原子序數依次增大.其中A元素基態原子第一電離能比B元素基態原子的第一電離能大,B的基態原子的L層、R基態原子的M層均有2個單電子,D是第Ⅷ族中原子序數最小的元素.
已知A、B、R、D都是周期表中前四周期的元素,它們的原子序數依次增大.其中A元素基態原子第一電離能比B元素基態原子的第一電離能大,B的基態原子的L層、R基態原子的M層均有2個單電子,D是第Ⅷ族中原子序數最小的元素.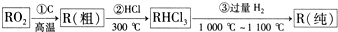
分析 B的基態原子的L層、R基態原子的M層均有2個單電子,則最外層電子數可能為4或6,B可能為C或O元素,R可能為Si或S元素,D是第Ⅷ族中原子序數最小的元素,應為Fe,A元素基態原子第一電離能比B元素基態原子的第一電離能大,且A的原子序數小于B,則A是N元素、B是O元素,高純度R的單質在現代信息技術與新能源開發中具有極為重要的地位,則R是Si元素,
(1)D是Fe元素,其原子核外有26個電子,根據構造原理書寫基態D原子的電子排布式;
(2)SiO2和C在高溫下發生置換反應生成粗Si,粗硅和HCl在300℃條件下反應生成SiHCl3,SiHCl3和過量氫氣在1000℃-1100℃條件下反應生成純硅,
③的反應為SiHCl3和氫氣的反應,生成Si和HCl,分子晶體熔沸點較低,該分子中Si原子價層電子對個數是4且不孤電子對,根據價層電子對互斥理論判斷Si原子的軌道雜化類型及空間構型;
(3)原子軌道中電子處于全滿、全空或半滿最穩定;N、O兩元素分別與Si形成的共價鍵中,元素的非金屬性越強,其形成的化合物中極性鍵的極性越強;等電子體中原子個數相等及價電子數相等;
(4)該晶胞是體心立方晶胞,該晶胞中Fe原子個數=1+8×$\frac{1}{8}$=2,其配合物是8,每個Fe原子的質量=$\frac{M}{{N}_{A}}$,則該晶胞質量就是兩個Fe原子質量.
解答 解:B的基態原子的L層、R基態原子的M層均有2個單電子,則最外層電子數可能為4或6,B可能為C或O元素,R可能為Si或S元素,D是第Ⅷ族中原子序數最小的元素,應為Fe,A元素基態原子第一電離能比B元素基態原子的第一電離能大,且A的原子序數小于B,則A是N元素、B是O元素,高純度R的單質在現代信息技術與新能源開發中具有極為重要的地位,則R是Si元素,
(1)D是Fe元素,其原子核外有26個電子,根據構造原理書寫基態D原子的電子排布式為[Ar]3d64s2,
故答案為:[Ar]3d64s2;
(2)SiO2和C在高溫下發生置換反應生成粗Si,粗硅和HCl在300℃條件下反應生成SiHCl3,SiHCl3和過量氫氣在1000℃-1100℃條件下反應生成純硅,
③的反應為SiHCl3和氫氣的反應,生成Si和HCl,反應方程式為SiHCl3+H2 $\frac{\underline{\;1000℃-1100℃\;}}{\;}$ Si+3HCl;
分子晶體熔沸點較低,該物質熔沸點較低,為分子晶體,該分子中Si原子價層電子對個數是4且不孤電子對,根據價層電子對互斥理論判斷Si原子的軌道雜化類型及空間構型分別為sp3、四面體形,
故答案為:SiHCl3+H2 $\frac{\underline{\;1000℃-1100℃\;}}{\;}$ Si+3HCl;分子晶體;sp3;四面體形;
(3)原子軌道中電子處于全滿、全空或半滿最穩定,N原子的2p能級處于較穩定的半充滿狀態,所以N原子比O原子第一電離能大;N、O兩元素分別與Si形成的共價鍵中,元素的非金屬性越強,其形成的化合物中極性鍵的極性越強,因為O元素的非金屬性大于N,則極性O-Si鍵>N-Si鍵;等電子體中原子個數相等及價電子數相等,N3-中含有3個原子、價電子數是16,與該離子互為等電子體的氮氧化物為N2O,
故答案為:N原子的2p能級處于較穩定的半充滿狀態;O-Si鍵;N2O;
(4)該晶胞是體心立方晶胞,該晶胞中Fe原子個數=1+8×$\frac{1}{8}$=2,體心上的Fe原子被頂點上的8個原子包圍,所以其配合物是8,每個Fe原子的質量=$\frac{M}{{N}_{A}}$g,則該晶胞質量就是兩個Fe原子質量=2×$\frac{M}{{N}_{A}}$g=2×$\frac{56}{{N}_{A}}$g=$\frac{112}{{N}_{A}}$g,
故答案為:$\frac{112}{{N}_{A}}$g.
點評 本題考查物質結構和性質,為高頻考點,涉及晶胞計算、等電子體判斷、原子結構、微粒空間構型判斷等知識點,側重考查學生分析判斷計算能力,注意(2)中SiHCl3是四面體而不是正四面體結構,應為Si-H、Si-Cl不同導致的,為易錯點.


 課課練江蘇系列答案
課課練江蘇系列答案 名牌中學課時作業系列答案
名牌中學課時作業系列答案 明天教育課時特訓系列答案
明天教育課時特訓系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 油脂水解可得到氨基酸 | |
| B. | 蛋白質水解可以得到高級脂肪酸 | |
| C. | 維生素是一類高分子化合物 | |
| D. | 淀粉和纖維素的組成的化學式可表示為(C6H10O5)n,水解最終產物都是葡萄糖 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 15mol•L-1 | B. | 10mol•L-1 | C. | 5mol•L-1 | D. | 1mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
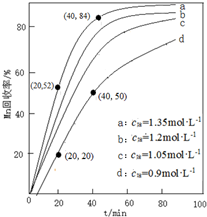
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 兩個反應均為氧化還原反應 | |
| B. | CO2與SO2不能用澄清石灰水鑒別 | |
| C. | CO2分子中各原子最外層均為8電子穩定結構 | |
| D. | 相同條件下:2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+270kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
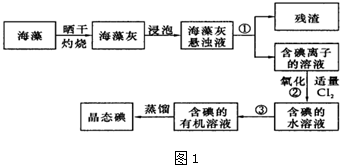
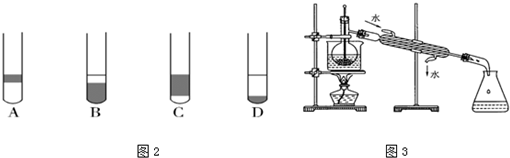
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溫室效應 | B. | 氮的氧化物排放 | C. | 白色污染 | D. | 對臭氧層的破壞 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④⑤ | B. | ①②③⑥ | C. | ②③④⑥ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com