解:(一)由硫酸試劑瓶標簽上的內容可知,該濃硫酸密度為1.84g/ml,質量分數為98%.
所以濃H
2SO
4的物質的量濃度c=
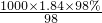
mol/L=18.4mol/L.
故答案為:18.4mol/L.
(二)(1)容量瓶沒有240ml規格,選擇體積相近的容量瓶,故應用250ml的容量瓶.
根據稀釋定律,稀釋前后溶質的物質的量不變,來計算濃硫酸的體積,設濃硫酸的體積為xmL,所以xmL×18.4mol/L=250mL×0.46mol/L,解得:x≈6.3.
故答案為:6.3.
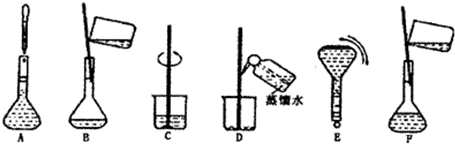
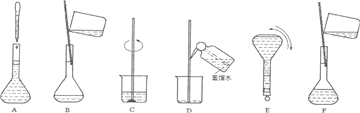
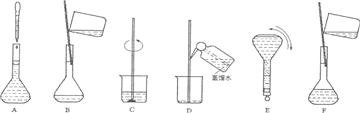
(2)操作步驟有計算、量取、稀釋、移液、洗滌移液、定容、搖勻等操作,用10mL量筒量取(用到膠頭滴管),在燒杯中稀釋,用玻璃棒攪拌,冷卻后轉移到250mL容量瓶中,并用玻璃棒引流,洗滌2-3次,將洗滌液轉移到容量瓶中,加水至液面距離刻度線1~2cm時,改用膠頭滴管滴加,最后定容顛倒搖勻.
所以必須用的儀器為:①燒杯、③250mL容量瓶、⑤玻璃棒、⑦10mL量筒、⑧膠頭滴管.
故答案為:①③⑤⑦⑧
(3)由(2)中操作步驟可知,實驗過程先后次序排列CBDFAE.
故答案為:CBDFAE.
(4)該同學實際配制得到的濃度為0.45mol/L,所配溶液濃度偏低.
A.量取濃H
2SO
4時仰視刻度,量取的濃硫酸的體積增大,所配溶液濃度偏高;
B.最后需要定容,容量瓶不干燥,含有少量蒸餾水,對溶液濃度無影響;
C.沒有將洗滌液轉入容量瓶,轉移到容量瓶中溶質硫酸的物質的量減小,所配溶液濃度偏低;
D.定容時仰視刻度,使溶液的體積偏大,所配溶液濃度偏低;
故選:CD.
分析:(一)根據c=

計算濃H
2SO
4的物質的量濃度.
(二)(1)根據溶液稀釋前后物質的量不變計算所需濃硫酸的體積.
(2)根據配制溶液的操作步驟選擇所用儀器;
(3)據配制溶液的實驗操作過程進行實驗步驟排序.
(4)分析操作對溶質的物質的量或對溶液的體積的影響,根據c=
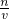
分析判斷.
點評:本題考查了一定物質的量濃度溶液的配制,注意從c=
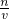
理解配制原理,注意操作順序排序中容量瓶中溶液體積多少確定BF位置.


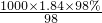 mol/L=18.4mol/L.
mol/L=18.4mol/L. 計算濃H2SO4的物質的量濃度.
計算濃H2SO4的物質的量濃度.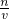 分析判斷.
分析判斷.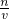 理解配制原理,注意操作順序排序中容量瓶中溶液體積多少確定BF位置.
理解配制原理,注意操作順序排序中容量瓶中溶液體積多少確定BF位置.