
| A. | 其分子結構呈三角形 | B. | 分子中不存在孤對電子 | ||
| C. | 它的沸點比三氯化磷沸點低 | D. | 三氯化氮水解有硝酸生成 |
分析 A.根據價電子對互斥理論確定微粒的空間構型,NCl3中N原子采取SP3雜化,分子形狀為三角錐形;
B.NCl3中N原子成3個N-Cl鍵,有1對孤對電子;
C.結構相似分子晶體中,其熔沸點與相對分子質量成正比;
D.水解中NCl3的負價原子結合水的正價原子,NCl3的正極原子結合水的負極基團.
解答 解:A.NCl3中價層電子對個數=σ鍵個數+孤電子對個數=3+$\frac{5-3×1}{2}$=4,所以原子雜化方式是sp3,分子形狀為三角錐形,故A錯誤;
B.NCl3中N原子成3個N-Cl鍵,孤電子對個數=$\frac{5-3×1}{2}$=1,故B錯誤;
C.NCl3和PCl3結構相似,且都是分子晶體,NCl3的相對分子質量比PCl3的小,故其沸點比三氯化磷沸點低,故C正確;
D.NCl3中N元素為-3價,結合水的正價原子H,生成NH3,Cl元素為+1價,結合水的負價基團OH,生成HClO,故D錯誤;
故選C.
點評 本題以信息的形式考查NCl3分子空間結構、熔沸點、水解原理等知識,明確信息并結合所學知識即可解答,題目難度不大,D選項中產物判斷為易錯點,理解水解原理為關鍵.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
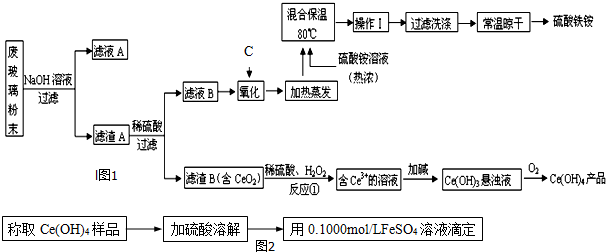
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該硫酸的物質的量濃度為9.2mol•L-1 | |
| B. | 用該硫酸配制稀硫酸時必須用到托盤天平 | |
| C. | 配制200mL 4.6mol/L的稀硫酸需量取該硫酸50mL | |
| D. | 該硫酸與等質量的水混合所得溶液的物質的量濃度大于9.2mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 18O原子核內的中子數為8 | B. | 16O2和18O2的化學性質幾乎相同 | ||
| C. | H216O與H218O質子數不同 | D. | H2和D2屬于同位素 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
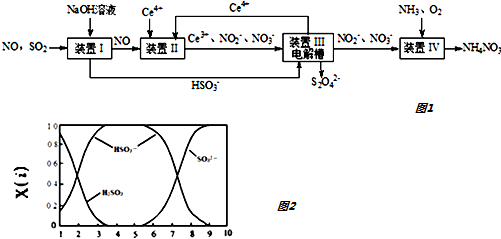
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2(HCl):通過水洗滌 | B. | NO(NH3):通過水洗滌 | ||
| C. | NH4Cl(NaCl):加熱混合物 | D. | NH4Cl溶液(I2):用CCl4萃取 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同濃度的下列溶液:①NH4Al(SO4)2②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+) 由大到小的順序是:①>②>③>④ | |
| B. | 相同溫度下,將足量氯化銀固體分別放入相同體積的①蒸餾水②0.1mol•L-1鹽酸、③0.1mol•L-1氯化鎂溶液、④0.1mol•L-1硝酸銀溶液中,Ag+濃度:①>④=②>③ | |
| C. | 常溫下將NaHSO3和NaHCO3兩溶液混合后,溶液呈中性,則混合后的溶液中:c (Na+)=c(HSO3-)+c(HCO3-)+2c(CO32-)+2c(SO32-) | |
| D. | 相同條件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀鹽酸三種溶液中由水電離出的c(H+):①>②>③ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com